 |
Главная |
Сведения о строении вещества
|
из
5.00
|
Упрощая физику явлений, будем считать, что основными элементарными частицами, из которых построены атомы, являются протоны, нейтроны и электроны. Все вещества состоят из атомов. Из атомов состоят молекулы. Из молекул состоит вещество. Вещество может находиться в газообразном, жидком или твёрдом состоянии. Для того чтобы разобраться в том, как устроены и работают современные приборы, необходимо систематизировать некоторые основные положения физики, начиная со структуры атомов и молекул [1-3,5].
Физика рассматривает атомы как частицы, состоящие из положительно заряженных ядер, окружённых электронными оболочками. Электроны относятся к категории микрочастиц, которым присущ принцип дуализма, то есть они обладают как свойствами частицы, так и свойствами волны. Ни видеть, ни осязать электроны нельзя. Поэтому, изучая их, приходится пользоваться моделями и абстракциями. Простейшей, наиболее наглядной моделью, является модель Н. Бора, в которой электроны уподобляются шарикам, вращающимся вокруг ядра по определённым орбитам. С точки зрения квантовой физики такое представление ошибочно, так как микрочастица не может одновременно обладать определёнными значениями координаты и импульса. Поэтому применительно к микрочастице понятие траектории теряет смысл. Квантовая механика в состоянии предсказать лишь вероятность нахождения электрона в данной точке пространства. Эта вероятность представляет собой «усреднённую» картину поведения электрона, что позволяет представить электрон в виде облака, которое называют орбиталью.
Если в атоме водорода, удаляясь от ядра, проследить вероятность нахождения электрона, то окажется, что у самого ядра она равна нулю, потом возрастает, достигая максимального значения на расстоянии 0,53∙10-8 см от ядра, а затем постепенно убывает. Расстояние r = 0,53∙10-8 см условно принимают за радиус орбиты в атоме водорода, а сам электрон рассматривают в виде шарика массой m = 9,1∙10-31 кг и зарядом q = 1,6∙10-19 Кл. Количество вращающихся вокруг ядра электронов определяется порядковым номером химического элемента в периодической системе Д. И. Менделеева: в атоме водорода – один электрон, в атоме гелия – два и т. д.
Движение электронов вокруг ядра происходит по строго определённым орбитам так, что на длине орбиты укладывается целое число длин волн, называемых волнами Де Бройля. При этом условии на длине орбиты образуется стоячая волна и не происходит излучения электромагнитной энергии. В противном случае электрон будет терять свою энергию, радиус орбиты станет уменьшаться и в результате электрон окажется притянутым к ядру.
Длину волны можно определить, приравняв выражения для импульсов (количества движения) электрона, исходя из его волновой и корпускулярной природы
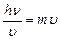 ,
,
где h –постоянная Планка ( h = 6,62∙10-34 эВ∙с); 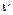 – частота электромагнитных колебаний;
– частота электромагнитных колебаний; 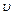 – скорость движения электрона по орбите.
– скорость движения электрона по орбите.
Учитывая, что 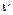 =
=  , получаем формулу для длины волны
, получаем формулу для длины волны
 . (1.1)
. (1.1)
Для получения стоячей волны должно выполняться условие
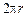 =
= 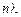 =
=  , (1.2)
, (1.2)
где r – радиус орбиты; n = 1,2,3,...
Возможные радиусы круговых орбит электрона в атоме водорода можно определить, исходя из того, что центробежная сила уравновешивается силой кулоновского притяжения электрона к ядру
 ,
,
где  = 8,85∙10-12 Ф/м. Откуда получаем
= 8,85∙10-12 Ф/м. Откуда получаем
 . (1.3)
. (1.3)
Значение  найдём из выражения (1.2), подставим его в уравнение (1.3), из которого получим уравнение для возможных радиусов круговых орбит в атоме водорода
найдём из выражения (1.2), подставим его в уравнение (1.3), из которого получим уравнение для возможных радиусов круговых орбит в атоме водорода
 . (1.4)
. (1.4)
При п = 1 получаем r = 0,53∙10-8 см.
Находясь на какой-либо орбите, электрон обладает энергией, складывающейся из кинетической энергии движения электрона по орбите Ek и потенциальной энергии притяжения электрона к ядру Eп.
Для атома водорода
Ek = 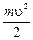 , (1.5)
, (1.5)
E п =  . (1.6)
. (1.6)
Подставляя в (1.5) уравнение (1.3), получаем
Ek = 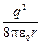 . (1.7)
. (1.7)
Полная энергия электрона
E = Ek +E п = 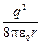
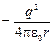 ≈
≈  . (1.8)
. (1.8)
Подставляя (1.4) в (1.8), получаем
E = 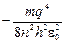 . (1.9)
. (1.9)
Подставив значения 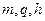 и
и  , получим
, получим
E = 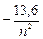 эВ.
эВ.
В начальном (невозбуждённом) состоянии электрон в атоме водорода находится на наиболее близкой к ядру орбите и обладает энергией Е = –13,6 эВ. Путём внешнего энергетического воздействия он может быть переведён на более удалённую орбиту. Такое состояние атома называется возбуждённым, оно является неустойчивым. В любом атоме электроны стремятся занять наиболее низкие энергетические уровни, поэтому спустя некоторое время электрон вернётся на первоначальную орбиту, выделив при этом квант энергии, равный разности соответствующих энергетических уровней.
В многоэлектронных атомах потенциальная энергия электрона зависит не только от его расстояния до ядра, но и от расстояний до каждого из остальных электронов, вследствие чего численные значения радиусов орбит и, соответственно, величины энергии не совпадают с численными значениями радиусов и энергии для атома водорода. Вращение электронов в этих атомах может происходить как по круговым, так и по эллиптическим орбитам. Движение электрона по круговой орбите соответствует сферическому электронному облаку, а движение по эллиптической орбите – облаку в форме гантели. При этом электроны стремятся занять наиболее низкие энергетические уровни, но при условии, что на каждом энергетическом уровне находится не более двух электронов (принцип Паули). Чем больше электронов в атоме, тем более высокие энергетические уровни они занимают. Возможные энергетические состояния электронов характеризуют четырьмя квантовыми числами.
Главное квантовое число п определяет радиус круговой орбиты или большую полуось эллиптической орбиты. Оно может принимать значение п = 1,2,3 и т. д. Чем больше п, тем больше радиус орбиты и энергия электрона. Состояния электрона, определяемые главным квантовым числом, называют энергетическими уровнями.
Орбитальное квантовое число l определяет малую полуось эллиптической орбиты. Оно может принимать значения l = 0,1,2,..., (n–1). Значение l = 0 соответствует круговой орбите. Энергетические состояния, характеризующиеся различными значениями l, называют подуровнями. Значению l = 0 соответствует s-подуровень, значению l = 1 – р-подуровень, значению l = 2 – d-подуровень, значению l = 3 –f-подуровень.
Магнитное квантовое число топределяет пространственную ориентацию эллиптической орбиты. Оно может принимать значения т = 0, ±1, ±2, ..., ±1. Каждому квантовому числу l соответствует (2 l + 1) по-разному ориентированных орбит. При l = 1 возможны три взаимно перпендикулярных р-орбиты; орбитальному квантовому числу l = 2 соответствует пять возможных пространственных ориентаций орбит, называемых d-орбитами; квантовому числу l = 3 соответствует семь f-орбит.
Спиновое квантовое число sопределяет момент количества движения электрона вокруг собственной оси. Вектор момента количества движения может быть параллелен или антипараллелен вектору орбитального момента. Спин электрона равен половине постоянной Планка, поэтому он равен +0,5 или -0,5.
Под химической связью понимают взаимодействие между атомами, в результате которого образуются молекулы и твердые тела. Химическая связь осуществляется посредствам электронов, находящихся на внешних, не полностью занятых электронных оболочках. Эти электроны называют валентными. Независимо от природы сил, возникающих при сближении частиц, характер взаимодействия между атомами остаётся одинаковым (рисунок 1.4):на относительно больших расстояниях появляются силы притяжения Fnp, быстро увеличивающиеся с уменьшением расстояния x между частицами (кривая 1); на небольших расстояниях возникают силы отталкивания F от , которые с уменьшением расстояния увеличиваются гораздо быстрее, чем F пр (кривая 2). На расстоянии x = r 0 силы отталкивания уравновешивают силы притяжения и результирующая сила взаимодействия F обращается в нуль (кривая 3). Состояние частиц, сближённых на расстояние r 0, является состоянием равновесия. Существует несколько видов химических связей.
 Ковалентная связьвозникает в результате перекрытия электронных облаков отдельных атомов при их сближении, вследствие чего возрастает плотность отрицательного заряда в межъядерном пространстве, что приводит к появлению сил притяжения, уравновешивающих силы взаимного отталкивания между ядрами. Перекрытие электронных оболочек сближающихся атомов приводит к обобществлению электронов. В этом случае уже нельзя говорить о принадлежности электрона одному из атомов: электроны принадлежат одновременно нескольким атомам, образующим молекулу или твёрдое тело. Подобным образом создаётся молекула водорода: в разъединённых атомах водорода s-орбиты имеют сферическую симметрию с антипараллельной ориентацией спинов. При объединении атомов в молекулу образуется структура, показанная на рисунке 1.5.
Ковалентная связьвозникает в результате перекрытия электронных облаков отдельных атомов при их сближении, вследствие чего возрастает плотность отрицательного заряда в межъядерном пространстве, что приводит к появлению сил притяжения, уравновешивающих силы взаимного отталкивания между ядрами. Перекрытие электронных оболочек сближающихся атомов приводит к обобществлению электронов. В этом случае уже нельзя говорить о принадлежности электрона одному из атомов: электроны принадлежат одновременно нескольким атомам, образующим молекулу или твёрдое тело. Подобным образом создаётся молекула водорода: в разъединённых атомах водорода s-орбиты имеют сферическую симметрию с антипараллельной ориентацией спинов. При объединении атомов в молекулу образуется структура, показанная на рисунке 1.5.
Рисунок 1.4 – Виды химических связей
 |
Рисунок 1.5 – Структура молекулы водорода
В зависимости от того, симметричную или асимметричную структуру имеют молекулы, они могут быть неполярными и полярными. В неполярных молекулах центры положительных и отрицательных зарядов совпадают (рисунок 1.6, а), в полярных они находятся на некотором расстоянии друг от друга (рисунок 1.6, б), в результате чего образуется диполь, характеризующийся дипольным моментом т = ql ( q –заряд электрона).
Ковалентная связь типична для органических молекул. Вместе с тем, она может иметь место и в твердых веществах. Примером могут служить атомы алмаза, кремния и германия, которые входят в четвертую группу периодической системы элементов. Они имеют валентность, равную четырем, и в твердом теле образуют структуру, в которой каждый атом связан ковалентными связями с четырьмя ближайшими своими соседями (рисунок 1.6, в). В такой структуре происходит обобществление валентных электронов, при котором каждый атом оказывается окруженным восемью обобществленными электронами. Такая связь характеризуется очень высокой прочностью.
 |
а б в
Рисунок 1.6 – Неполярные и полярные молекулы
Металлическая связьвозникает между атомами с небольшим числом валентных электронов, что характерно для металлов. При сближении таких атомов, как и при ковалентной связи, происходит перекрывание электронных оболочек и обобществление валентных электронов с той лишь разницей, что обобществленные электроны не локализуются вблизи своих атомов, а свободно перемещаются между атомами, образуя «электронный газ». При этом атомы, отдавшие свои электроны, превращаются в положительные ионы, силы отталкивания между которыми уравновешиваются силами притяжения между ионами и электронами. В результате такой связи образуется кристаллическая структура, в которой атомы металла находятся на строго определённом расстоянии друг от друга в среде коллективизированных электронов (рисунок 1.7).
 |
Рисунок 1.7 – Кристаллическая структура металла
Ионная связьвозникает между атомами металлов, имеющими на внешней орбите один электрон, и атомами металлоидов, имеющими на внешней орбите семь электронов. В этом случае при сближении атомов происходит переход валентных электронов от металлического атома к металлоидному, в результате чего образуются разноименные ионы, между которыми возникает электростатическое притяжение.
Так происходит, например, образование кристаллов хлористого натрия (NaCl). В таких кристаллах каждый ион связан с шестью ионами противоположного знака, в результате чего образуется структура, показанная на рисунке 1.8.
 |
Рисунок 1.8 – Структура кристалла хлористого натрия
Молекулярная связьвозникает между молекулами с ковалентным характером внутримолекулярного взаимодействия.
Межмолекулярное притяжение возникает при согласованном движении валентных электронов в соседних молекулах, то есть таком движении, когда в любой момент времени электроны соседних молекул максимально удалены друг от друга и максимально приближены к положительным зарядам ядер соседних молекул (рисунок 1.9). Тогда силы притяжения валентных электронов ядром соседней молекулы оказываются сильнее сил взаимного отталкивания электронов оболочек этих молекул. За счет молекулярных связей образуется твердое состояние инертных газов, водорода, кислорода, азота. Молекулярная связь легко разрушается тепловым движением.
 Существуют две разновидности твёрдых тел: аморфные и кристаллические. Аморфные тела характеризуются случайным (хаотическим) расположением частиц (атомов, ионов или молекул). В кристаллических телах частицы расположены строго упорядоченно, на определённом расстоянии друг от друга, образуя пространственную кристаллическую решетку. Частицы, расположенные в узлах решётки, не могут покидать состояние равновесия, так как при удалении от этих положений появляются силы, стремящиеся вернуть их обратно. Единственной формой движения этих частиц являются беспорядочные колебания около положения равновесия. Энергия каждого такого колебания квантована. Порцию энергии тепловых колебаний называют фононом.
Существуют две разновидности твёрдых тел: аморфные и кристаллические. Аморфные тела характеризуются случайным (хаотическим) расположением частиц (атомов, ионов или молекул). В кристаллических телах частицы расположены строго упорядоченно, на определённом расстоянии друг от друга, образуя пространственную кристаллическую решетку. Частицы, расположенные в узлах решётки, не могут покидать состояние равновесия, так как при удалении от этих положений появляются силы, стремящиеся вернуть их обратно. Единственной формой движения этих частиц являются беспорядочные колебания около положения равновесия. Энергия каждого такого колебания квантована. Порцию энергии тепловых колебаний называют фононом.
Рисунок 1.9 – Молекулярная связь между соседними молекулами
Кристаллические тела могут существовать в виде отдельных крупных кристаллов (монокристаллы) или же состоять из отдельных зёрен (поликристаллы).
В поликристаллах в пределах каждого зерна частицы расположены периодически, но при переходе от одного зерна к другому на границах раздела эта периодичность нарушается. Монокристаллы обладают анизотропией, то есть их механические, физические, тепловые и другие свойства различны в разных направлениях. Поликристаллы изотропны, то есть их свойства одинаковы во всех направлениях.
Кристаллические тела состоят из большого числа одинаковых многогранников. Каждый такой многогранник называется элементарной ячейкой кристалла. Элементарные ячейки характеризуются длиной ребер a, b, c,называемых постоянными решетки, и углами между ребрами  (рисунок 1.10). Оси x, y, z, совпадающие с ребрами a, b, c, называются кристаллографическими осями. За начало координат этих осей выбирают один из узлов решетки.
(рисунок 1.10). Оси x, y, z, совпадающие с ребрами a, b, c, называются кристаллографическими осями. За начало координат этих осей выбирают один из узлов решетки.
 |
Рисунок 1.10 – Элементарная ячейка кристалла
Большинство материалов в твёрдом состоянии имеют только один определённый тип кристаллической решётки. Однако некоторые из веществ могут существовать в виде двух или нескольких кристаллических структур, это явление называется полиморфизмом. Примером может служить углерод, который существует либо в виде графита, либо в виде алмаза.
Твёрдые тела, имеющие кристаллическую структуру, обладают неоднородностью своих свойств в различных направлениях. При определении свойств кристаллов принято указывать расположение кристаллографических плоскостей и направлений, перпендикулярных этим плоскостям. Для этого используют индексы Миллера.
Основные понятия зонной теории
В изолированном атоме электроны способны занимать лишь дискретные энергетические уровни, определяемые силами притяжения к ядру и силами отталкивания от других электронов. В твёрдом теле атомы расположены настолько близко друг к другу, что между ними возникают новые силы взаимодействия – это силы отталкивания между ядрами и между электронами соседних атомов и силы притяжения между всеми ядрами и всеми электронами. Под действием этих сил энергетические состояния в атомах изменяются: энергия одних электронов увеличивается, других – уменьшается. В результате вместо дискретных уровней изолированного атома образуются энергетические зоны, состоящие из очень близко расположенных энергетических уровней, плотность которых возрастает по мере удаления от краёв зоны по параболическому закону, достигая максимума в середине зоны [1-2].
 Механизм образования энергетических зон схематически показан на рисунке 1.11. По мере сближения атомов (уменьшения расстояний) сначала расщепляются самые высокие энергетические уровни, затем по мере сближения атомов – более низкие.
Механизм образования энергетических зон схематически показан на рисунке 1.11. По мере сближения атомов (уменьшения расстояний) сначала расщепляются самые высокие энергетические уровни, затем по мере сближения атомов – более низкие.
Рисунок 1.11 – Механизм образования энергетических зон
При сближении атомов на расстояние а0образуется устойчивая кристаллическая структура, которой соответствует энергетическая диаграмма, показанная в левой части рисунка. Разрешённые зоны отделены друг от друга запрещёнными зонами, в которых отсутствуют разрешённые уровни. Ширина разрешённых зон по мере перемещения вверх по энергетической шкале возрастает, а ширина запрещённых зон соответственно уменьшается. Во многих случаях может иметь место перекрытие разрешённых энергетических зон. Подобно энергетическим уровням в изолированных атомах энергетические зоны могут быть полностью заполненными электронами, частично заполненными и свободными. Всё зависит от структуры электронных оболочек изолированных атомов и межатомных расстояний в кристалле. Внутренние оболочки изолированных атомов полностью заполнены электронами, поэтому соответствующие им зоны также оказываются заполненными. Самую верхнюю из зон, частично или полностью заполненную электронами, называют валентной зоной, а ближайшую к ней незаполненную электронами – зоной проводимости. Взаимное положение этих зон зависит от структуры оболочек изолированных атомов и определяет большинство процессов в твёрдом теле.
Из всего вышеизложенного следует, что с точки зрения зонной теории все твёрдые тела можно подразделить на две основные группы: материалы, у которых валентная зона перекрывается зоной проводимости, и материалы, у которых валентная зона и зона проводимости разделены запрещённой зоной. В первом случае незначительное внешнее энергетическое воздействие переводит электроны на более высокие энергетические уровни, что обусловливает хорошую электропроводность материалов. Во втором случае переходы на более высокие энергетические уровни связаны с необходимостью внешнего энергетического воздействия, превышающего ширину запрещённой зоны. Материалы, в энергетической диаграмме которых отсутствует запрещённая зона, относятся к категории проводников, материалы с узкой запрещённой зоной (менее 3 эВ) – к категории полупроводников и материалы с широкой запрещённой зоной (более 3 эВ) – к категории диэлектриков.
Характер энергетического спектра у металлических проводников, полупроводников и диэлектриков существенно различен [1]. B металлических проводниках валентная зона заполнена полностью или перекрывается с зоной проводимости. В полупроводниках и диэлектриках зона проводимости и валентная зона разделены некоторым энергетическим зазором, называемым запрещённой зоной. Формально к полупроводникам относят вещества, у которых запрещённая зона меньше 3 эВ. Вещества с более широкой запрещённой зоной относят к диэлектрикам. У реальных диэлектриков ширина запрещённой зоны может достигать 10 эВ. Различие в положении энергетических зон у диэлектриков, полупроводников и металлических проводников показано на рисунке 1.12.


Рисунок 1.12 – Энергетические зоны электротехнических материалов:
1 – заполненная электронами зона; 2 – зона свободных энергетических уровней; 3 – запрещённая зона шириной DЭ
Согласно зонной теории, электроны валентной зоны имеют практически одинаковую свободу движения во всех твёрдых телах, независимо от того, являются ли они металлами или диэлектриками. Движение осуществляется путём туннельного перехода электронов от атома к атому. Для объяснения различий в электрических свойствах материалов необходимо принять во внимание различную реакцию на внешнее электрическое поле электронов заполненной и незаполненной зон. Внешнее электрическое поле стремится нарушить симметрию в распределении электронов по скоростям, ускоряя электроны, движущиеся в направлении действующих электрических сил, и замедляя частицы с противоположно направленным импульсом. Однако подобное ускорение и замедление связано с изменением энергии электронов, что должно сопровождаться переходом их в новые квантовые состояния. Очевидно, такие переходы могут осуществляться лишь в том случае, если в энергетической зоне имеются свободные уровни. В типичных случаях добавочная энергия, приобретаемая электронами на длине свободного пробега под действием электрического поля, составляет (10-8 – 10-4) эВ, т. е. намного превосходит расстояние между подуровнями в зоне.
В металлах, где зона не полностью укомплектована электронами, даже слабое поле способно сообщить электронам достаточный импульс, чтобы вызвать их переход на близлежащие свободные уровни. По этой причине металлы являются хорошими проводниками электрического тока.
В полупроводниках и диэлектриках при температуре 0 К все электроны находятся в валентной зоне, а зона проводимости абсолютно свободна. Электроны полностью заполненной зоны не могут принимать участия в создании электрического тока. Для появления электропроводности необходимо часть электронов перевести из валентной зоны в зону проводимости. Энергии электрического поля недостаточно для осуществления такого перехода, требуется более сильное энергетическое воздействие, например, нагревание твёрдого тела.
Средняя кинетическая энергия тепловых колебаний атомов в кристаллической решётке приблизительно равна (3/2)kT. При комнатной температуре эта величина составляет приблизительно 0,04 эВ, что в общем случае существенно меньше ширины запрещённой зоны ∆Э. Однако следует иметь в виду, что тепловая энергия неравномерно распределяется между частицами. В каждый момент времени имеется небольшое число атомов, у которых амплитуда и энергия тепловых колебаний значительно превышают среднее значение. В процессе тепловых колебаний атомы взаимодействуют не только друг с другом, но и с электронами, передавая им часть тепловой энергии. Именно за счёт таких тепловых флуктуаций некоторые из электронов могут перейти из валентной зоны в зону проводимости. Очевидно, чем выше температура и меньше запрещённая зона, тем выше интенсивность межзонных переходов. У диэлектриков запрещённая зона может быть настолько велика, что электронная электропроводность не играет определяющей роли.
Существуют две разновидности твёрдых тел: аморфные и кристаллические. Аморфные тела характеризуются случайным (хаотическим) расположением частиц (атомов, ионов или молекул). В кристаллических телах частицы расположены строго упорядоченно, на определённом расстоянии друг от друга, образуя пространственную кристаллическую решётку. Частицы, расположенные в узлах решётки, не могут покидать состояние равновесия, так как при удалении от этих положений появляются силы, стремящиеся вернуть их обратно. Единственной формой движения этих частиц являются беспорядочные колебания около положения равновесия. Энергия каждого такого колебания квантована. Порцию энергии тепловых колебаний называют фононом.
При каждом акте возбуждения и перехода электронов в зону проводимости появляются энергетические вакансии в распределении электронов по состояниям валентной зоны, называемые «дырками». При наличии дырок электроны валентной зоны могут совершать эстафетные переходы с уровня на уровень. Во внешнем электрическом поле дырка движется противоположно движению электрона, т. е. ведёт себя как некоторый положительный заряд с отрицательной эффективной массой. Таким образом, дырки обеспечивают участие валентных электронов в процессе электропроводности.
Процесс перехода электронов в свободное состояние сопровождается и обратным явлением, т. е. возвратом электронов в нормальное состояние. В результате в веществе при любой температуре наступает динамическое равновесие, т. е. количество электронов, переходящих в свободную зону, становится равным количеству электронов, возвращающихся обратно в нормальное состояние. С повышением температуры число свободных электронов в полупроводнике возрастает, а с понижением температуры до абсолютного нуля – убывает вплоть до нуля. Значит, вещество, представляющее собой при одних температурах диэлектрик, при других, более высоких, приобретает проводимость, т. е. наступает новое качественное состояние вещества.
Различие между проводимостями двух типов материалов – металлов и неметаллов – наиболее значительно при температурах, приближающихся к абсолютному нулю; различие же между двумя классами неметаллов – полупроводниками и диэлектриками – исчезает по мере приближения температуры к абсолютному нулю.
Электроны, находящиеся в зоне проводимости, нельзя считать абсолютно свободными. Такие электроны неизбежно будут взаимодействовать с периодическим потенциальным полем кристаллической решётки. При математическом описании поведения электронов в зоне проводимости пользуются понятием эффективной массы. Эффективная масса не определяет ни инерционных, ни гравитационных свойств электрона. Однако, вводя понятие эффективной массы, можно движение реального электрона в кристалле с массой m 0описывать как движение абсолютно свободного электрона, т. е. эффективная масса учитывает сложный характер взаимодействия электрона с кристаллической решёткой при его движении под действием силы внешнего электрического поля. Эффективная масса может во много раз отличаться от массы свободного электрона.
Энергию, необходимую для перевода электрона в свободное состояние или для образования дырки, может дать не только тепловое движение, но и другие источники энергии, например поглощённая материалом энергия света, энергия потока электронов и ядерных частиц, энергия электрических и магнитных полей, механическая энергия и т. д. Увеличение же числа свободных электронов или дырок под воздействием какого-либо вида энергии способствует повышению электропроводности, увеличению тока, появлению электродвижущих сил.
Электрические свойства определяются условиями взаимодействия и расстояниями между атомами вещества и не являются непременной особенностью данного атома. Как было показано, углерод в виде алмаза является диэлектриком, а в виде графита он обладает большой проводимостью.
Таким образом, электрические свойства всех твёрдых тел определяют теоретически с единой точки зрения – энергия возбуждения носителей заряда или энергия активации электропроводности равна нулю у металлов и непрерывно возрастает в ряду полупроводников, условно переходящих при увеличении этой энергии в ряд диэлектриков; хорошо проводящие металлы и хорошо изолирующие диэлектрики представляют собой крайние члены того непрерывного ряда, в котором можно расположить твёрдые тела по этому признаку. Подводя итог сказанному, следует подчеркнуть, что зонная теория строго применима к твёрдым телам с ковалентными и металлическими связями.
Разделение твёрдых тел на полупроводники и диэлектрики носит в значительной мере условный характер [1,2]. По мере того, как в качестве полупроводников начинают использоваться материалы со все более широкой запрещённой зоной, деление тел на полупроводники и диэлектрики постепенно утрачивает свой изначальный смысл.
 |
2 ПРОВОДНИКОВЫЕ МАТЕРИАЛЫ
|
из
5.00
|
Обсуждение в статье: Сведения о строении вещества |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

