 |
Главная |
Диаграммы состояния сплавов
|
из
5.00
|
Диаграмма состояния показывает строение сплава в зависимости от соотношения компонентов и от температуры. Она строится экспериментально по кривым охлаждения сплавов (рисунок 2.3). В отличие от чистых металлов сплавы кристаллизуются не при постоянной температуре, а в интервале температур. Поэтому на кривых охлаждения сплавов имеются две критические точки. Критическими точками называются температуры начала и конца фазовых превращений. В верхней критической точке, называемой точкой ликвидус(t л), начинается кристаллизация. В нижней критической точке, которая называется точкой солидус(t с), кристаллизация завершается.
|
|

|
|
Рисунок 2.3 – Кривые охлаждения сплавов: а – механической смеси; б – твёрдого сплава
Диаграмму состояния строят в координатах температура – концентрация. Линии диаграммы разграничивают области одинаковых фазовых состояний. Вид диаграммы зависит от того, как взаимодействуют между собой компоненты. Для построения диаграммы состояния используют большое количество кривых охлаждения для сплавов различных концентраций. При построении диаграммы критические точки переносятся с кривых охлаждения на диаграмму и соединяются линией. В получившихся на диаграмме областях записывают фазы или структурные составляющие. Линия диаграммы состояния, на которой при охлаждении начинается кристаллизация сплава, называется линией ликвидус, а линия, на которой кристаллизация завершается, линией солидус.
Диаграмма состояния железоуглеродистых сплавов даёт представление о строении основных конструкционных сплавов – сталей и чугунов.
Компоненты, фазы и структурные составляющие сплавов железа с углеродом. Железо– пластичный металл серебристо-белого цвета. Твёрдость и прочность железа невысоки (НВ 80, σв= 250 МПа) при значительной пластичности (δ = 50 %). Температура плавления – 1539 °С, плотность – 7,83 г/см3. Железо имеет полиморфные модификации.
Углерод встречается в природе в виде двух модификаций – алмаза и графита. Графит имеет сложную гексагональную кристаллическую решётку. Он является мягким непрочным материалом, но с увеличением температуры прочность графита значительно возрастает. Температура плавления графита 3500 °С. С углеродом железо образует химическое соединение и твёрдые растворы внедрения.
Цементит – это химическое соединение железа с углеродом (карбид железа) Fe3C. В нем содержится 6,67 % углерода (по массе). Имеет сложную ромбическую кристаллическую решётку. Характеризуется очень высокой твёрдостью (НВ 800), крайне низкой пластичностью и хрупкостью.
Ферритом называется твёрдый раствор углерода в α-железе. Содержание углерода в феррите очень невелико – максимальное 0,02 % при температуре 727 °С. При комнатной температуре в феррите содержится не более 0,006 % углерода. Благодаря столь малому содержанию углерода свойства феррита совпадают со свойствами железа (низкая твёрдость и высокая пластичность). Твёрдый раствор углерода в δ-железе, существующий при температуре 1392-1539 ºС, также называют ферритом или высокотемпературным ферритом (δ-ферритом). Он характеризуется максимальной растворимостью углерода 0,1 % при температуре 1499 °С.
Аустенит – это твёрдый раствор углерода в γ-железе. Максимальное содержание углерода в аустените составляет 2,14 % (при температуре 1147 °С). Аустенит характеризуется высокой пластичностью и низкими прочностью и твёрдостью (НВ 220).
Перлит –это механическая смесь феррита с цементитом. Содержит 0,8% углерода, образуется из аустенита притемпературе 727 °С. Перлит является эвтектоидом.
Эвтектоид – это механическая смесь двух фаз, образующаяся из твёрдого раствора (а не из жидкого сплава, как эвтектика). Перлит имеет пластинчатое строение, т.е. состоит из чередующихся пластинок феррита и цементита. Возможно и зернистое строение перлита, когда он состоит из зёрен цементита, окруженных ферритом. Зернистый перлит значительно пластичнее пластинчатого, имеет меньшую твёрдость.
Ледебурит представляет собой эвтектическую смесь аустенита с цементитом. Содержит 4,3 % углерода, образуется из жидкого сплава при температуре 1147 °С. При температуре 727 °С аустенит, входящий в состав ледебурита, превращается в перлит, и ниже этой температуры ледебурит представляет собой механическую смесь перлита с цементитом. Ледебурит обладает высокой твёрдостью (НВ 600-700) и хрупкостью.
Фаза цементита имеет пять структурных форм: цементит первичный, образующийся из жидкого сплава; цементит вторичный, образующийся из аустенита; цементит третичный, образующийся из феррита; цементит ледебурита; цементит перлита.
Диаграмма железо-цементит. Практическое значение имеют сплавы железа с углеродом, содержащие углерода до 6,67 % (стали и чугуны). Поэтому рассматривают диаграмму состояния сплавов железа с углеродом только до этой концентрации, т.е. фактически рассматривается диаграмма железо-цементит (Fe-Fe3C). На рисунке 2.4 приведена диаграмма состояния сплавов железа с цементитом. На горизонтальной оси концентраций отложено содержание углерода от 0 до 6,67 %.

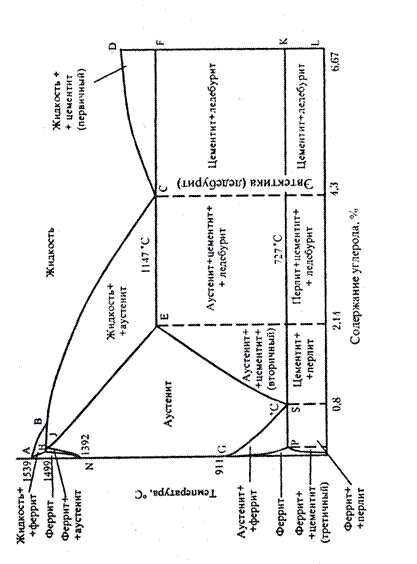
Левая вертикальная ось соответствует 100 % содержанию железа. На ней отложены температура плавления железа и температуры его полиморфных превращений. Правая вертикальная ось (6,67 % углерода) соответствует 100 % содержанию цементита. Буквенное обозначение точек диаграммы принято согласно международному стандарту и изменению не подлежит.
Линия ABCD диаграммы является линией ликвидус. На ней начинается кристаллизация: на участке АВ – феррита, ВС – аустенита и CD – первичного цементита. Линия AHJECF является линией солидус диаграммы.
Железоуглеродистые сплавы в зависимости от содержания углерода делятся на стали(до 2,14 % С) и чугуны(от 2,14 до 6,67 % С).
Главная роль в диаграмме состояния железоуглеродистых сплавов отводится её левой части – сталям, так как на превращениях, происходящих в стали, основана термическая обработка. Рассмотрим эти превращения. В результате кристаллизации образуется аустенит; при понижении температуры аустенит претерпевает превращения, связанные с изменением кристаллической решётки, – с переходом γ-железа в α-железо, и со снижением растворимости углерода с понижением температуры.
В точке S, соответствующей содержанию углерода 0,8 %, при температуре 727 °С аустенит полностью распадается, образуется перлит. Сталь, содержащую 0,8 % углерода, называют эвтектоидной. Её структура состоит из одного перлита. Сталь, содержащую менее 0,8 % углерода, называют доэвтектоидной, а сталь с содержанием более 0,8 % углерода – заэвтектоидной. Переход чистого железа из модификации γ-железа в α-железо происходит при температуре 911 °С.
Сплав, содержащий до 0,02 %углерода, не имеет после завершения всех превращений в структуре перлита. Такой сплав часто называют техническим железом. Структура технического железа представляет собой зёрна феррита или феррит с небольшим количеством третичного цементита.
Линия GSEдиаграммы называется линией верхних критических точек или линией начала превращения аустенита (при охлаждении). Линия GS обозначается А3 (Ас3 –при нагревании, А r 3 –при охлаждении). Линия SE обозначается Acml. Линия PSKдиаграммы (температура 727 °С) называется линией нижних критических точек, или линией перлитного превращения (при охлаждении). Она обозначается А1 (Ас1 – при нагревании, Аr1) – при охлаждении).
Рассмотрим теперь превращения в чугунах. Точка С (4,3 % углерода) представляет собой эвтектическую точку. Она соответствует температуре 1147 °С, при которой кристаллизуется сплав указанного содержания углерода, при этом одновременно выделяются из жидкого сплава кристаллы аустенита и первичного цементита, образуя эвтектическую смесь – ледебурит. Его структура представляет собой равномерную смесь кристаллов аустенита с цементитом.
Чугун, содержащий 4,3 % углерода, называется эвтектическим. Чугуны, содержащие менее 4,3 % углерода, называют доэвтектическими. Их кристаллизация начинается при температурах, лежащих на линии ВС, выделением аустенита, и заканчивается при температурах, лежащих на линии ЕС,образованием ледебурита. При дальнейшем понижении температуры растворимость углерода уменьшается и из аустенита начинает выделяться вторичный цементит. Когда углерода в аустените останется 0,8 %, при температуре 727 °С аустенит переходит в перлит.
Чугуны, содержащие более 4,3 %углерода, называют заэвтектическими. Их кристаллизация начинается при температурах, лежащих на линии CD. При этом выделяется первичный цементит. Кристаллизация заканчивается при температуре 1147 °С по линии CFобразованием ледебурита. Получившаяся структура остается неизменной. В составе ледебуритной эвтектики при температуре 727 °С аустенит переходит в перлит. Структура заэвтектических чугунов состоит из ледебурита и первичного цементита.
Диаграмма состояния железоуглеродистых сплавов позволяет установить температурные режимы кристаллизации сталей и белых чугунов, режимы горячей обработки давлением (ковки, прокатки, штамповки), режимы термообработки и т. д.
При очень медленном охлаждении кристаллизация может идти таким образом, что углерод будет выделяться в виде графита, а не цементита. Железоуглеродистые сплавы с содержанием углерода в виде графита называются серыми чугунами.
2.2.2Стали и сплавы
Сталь – важнейший материал, используемый в машиностроении. В отличие от чугуна она содержит меньше углерода и вредных примесей. Поэтому процесс получения стали состоит в удалении этих элементов. Основные способы получения стали: кислородно-конвертерный, мартеновский и в электропечах.
Углерод существенно влияет на свойства стали даже при незначительном изменении его содержания. В стали имеются две фазы – феррит и цементит. Количество цементита возрастает прямо пропорционально содержанию углерода. Как уже говорилось, феррит характеризуется высокой пластичностью и низкой твёрдостью, а цементит, напротив, очень низкой пластичностью и высокой твёрдостью. Поэтому с повышением содержания углерода до 1,2 % снижаются пластичность и вязкость стали и повышаются твёрдость и прочность.
Повышение содержания углерода влияет также и на технологические свойства стали. Ковкость, свариваемость и обрабатываемость резанием ухудшаются, но литейные свойства улучшаются.
Кроме железа и углерода в стали всегда присутствуют постоянные примеси. Наличие примесей объясняется технологическими особенностями производства стали (марганец, кремний) и невозможностью полного удаления примесей, попавших в сталь из железной руды (сера, фосфор, кислород, водород, азот). Возможны также случайные примеси (хром, никель, медь и др.).
Марганец и кремний вводят в любую сталь для раскисления, т.е. для удаления вредных примесей оксида железа FeO. Марганец также устраняет вредные сернистые соединения железа. При этом содержание марганца обычно не превышает 0,8 %, а кремния – 0,4 %. Марганец повышает прочность, а кремний упругость стали.
Фосфор растворяется в феррите, сильно искажает кристаллическую решётку, снижая при этом пластичность и вязкость, но повышая прочность. Вредное влияние фосфора заключается в том, что он сильно повышает температуру перехода стали в хрупкое состояние, т.е. вызывает её хладноломкость. Вредность фосфора усугубляется еще и тем, что он может распределяться в стали неравномерно. Поэтому содержание фосфора в стали ограничивается величиной 0,045 %.
Сера также является вредной примесью. Она нерастворима в железе и образует с ним сульфид железа FeS, который образует с железом легкоплавкую эвтектику. Эвтектика располагается по границам зёрен и делает сталь хрупкой при высоких температурах. Это явление называется красноломкостью. Количество серы в стали ограничивается 0,05 %.
Водород, азот и кислород содержатся в стали в небольших количествах. Они являются вредными примесями, ухудшающими свойства стали.
По химическому составу стали могут быть углеродистыми, содержащими железо, углерод и примеси, и легированными, содержащими дополнительно легирующие элементы, введённые в сталь с целью изменения её свойств.
По содержанию углерода стали делятся на низкоуглеродистые (до 0,25 %С), среднеуглеродистые (0,25-0,7 % С) и высокоуглеродистые (более 0,7 % С).
По назначению различают стали конструкционные, идущие на изготовление деталей машин, конструкций и сооружений, инструментальные, идущие на изготовление различного инструмента, а также стали специального назначения с особыми свойствами: нержавеющие, жаростойкие, жаропрочные, износостойкие, с особыми электрическими и магнитными свойствами и др.
По показателям качества стали классифицируются на обыкновенного качества, качественные, высококачественные и особо высококачественные. Качество стали характеризуется совокупностью свойств, определяемых процессом производства, химическим составом, содержанием газов и вредных примесей (серы и фосфора), а также коррозионностойкостью.
Коррозией называется разрушение металла под действием внешней агрессивной среды в результате её химического или электрохимического воздействия. Различают химическую коррозию, обусловленную воздействием на металл сухих газов и неэлектролитов (например, нефтепродуктов), и электрохимическую, возникающую под действием жидких электролитов или влажного воздуха. При химической коррозии происходит взаимодействие поверхности металла с окислительным компонентом коррозионной среды. Продуктом коррозии является химическое соединение металла с окислительным компонентом, например,
3Fe + 2O2 = Fe3O4.
Механизм электрохимической коррозии состоит в следующем. Если два соединённых проводником металла поместить в электролит, то образуется гальваническая пара, в которой металл с меньшим электродным потенциалом будет анодом, а с большим – катодом. При этом анод отдает ионы в электролит и растворяется. Чем меньше электродный потенциал металла, тем легче он отдаёт ионы и тем ниже его коррозионная стойкость. При погружении в электролит сплава его отдельные фазы имеют различные электродные потенциалы. Сплав представляет собой множество гальванических микропар. Разница электродных потенциалов разных фаз определяет интенсивность коррозионного процесса. Таким образом, причиной коррозии является электрохимическая неоднородность сплава. Поэтому чистые металлы и однофазные сплавы имеют большую коррозионную стойкость. Однако в однофазных сплавах имеются различные дефекты строения (примеси, границы зёрен, дислокации), которые играют роль анода при электрохимической коррозии.
Коррозионная стойкость металлов резко повышается при образовании на их поверхности сплошной прочной оксидной плёнки. Это явление называется пассивацией, а металлы, на поверхности которых образуется такая плёнка – пассивирующимися. К этим металлам относят алюминий, титан, хром, цинк.
По характеру коррозионного разрушения различают сплошную и местную коррозию. Сплошная коррозия захватывает всю поверхность металла. Её делят на равномерную и неравномерную в зависимости от того, одинаковая ли глубина коррозионного разрушения на разных участках. При местной коррозии поражения локальны. В зависимости от степени локализации различают пятнистую, язвенную, точечную, межкристаллитную и другие виды местной коррозии [4].
Наиболее опасными видами являются коррозионное растрескивание и межкристаллитная (интеркристаллитная) коррозия, которая распространяется в металле по границам зёрен. Она почти незаметна при внешнем осмотре, но изделия становятся непригодными, так как нарушается связь между зёрнами и резко снижается прочность.
Также весьма опасна коррозия под напряжением, которая происходит при одновременном воздействии коррозионной среды и механической нагрузки. Разновидностью этой коррозии является коррозионное растрескивание, при котором в металле образуется сетка тонких трещин, проходящих через зёрна. Этот вид коррозии также незаметен снаружи.
Мерой коррозионной стойкости металлов и сплавов служит скорость коррозии в данной среде при данных условиях. Скорость коррозии может оцениваться глубинным показателем (мм/год), или потерей массы металла в граммах за единицу времени, отнесённой к единице площади его поверхности, г/(м2ч).
Все рассмотренные выше конструкционные стали не обладают стойкостью против коррозии. Стали, обладающие устойчивостью против коррозии, называются коррозионностойкими (нержавеющими).
Коррозионная стойкость достигается при введении в сталь элементов, образующих на её поверхности тонкие и прочные оксидные плёнки, т.е. с помощью явления пассивации. При этом повышается электродный потенциал стали. Наилучший из этих элементов – хром. При введении в сталь более 12 % хрома её электродный потенциал возрастает скачкообразно и она становится устойчивой против коррозии в атмосфере, воде, ряде кислот, щелочей и солей. Стали, содержащие меньшее количество хрома, подвержены коррозии точно так же, как и углеродистые стали. В технике применяют хромистые и хромоникелевые коррозионностойкие стали.
Хромистые коррозионностойкие стали могут содержать 13, 17 или 25-27 %хрома. В зависимости от структуры, полученной при охлаждении на воздухе, различают хромистые стали ферритного (0,8X13, 12X17, 15Х25т, 15X28), мартенсито-ферритного (12X13) и мартенситного (20X13, 30X13, 40X13) классов.
Хромоникелевые коррозионностойкие стали обычно содержат 18 % хрома и 9-12 % никеля (03Х18Н12, 04Х18Н10, 08Х18Н10, 12Х18Н9, 12Х18Н10Т, 12Х18Н12Т, 17Х18Н9 и др.). Они имеют более высокую коррозионную стойкость по сравнению с хромистыми сталями, лучшие механические свойства, хорошо свариваются.
Применение коррозионностойких сталей является самым надёжным способом защиты от коррозии. Однако они значительно дороже обыкновенных углеродистых и низколегированных сталей. Кроме того, их применение не всегда возможно по техническим соображениям. Поэтому часто используют другие методы защиты металлических изделий от коррозии: нанесение защитных покрытий и плёнок (металлических и неметаллических), протекторную защиту, применение ингибиторов коррозии.
Распространённым средством защиты от коррозии является нанесение на защищаемый металл различных покрытий. Металлические покрытия делятся на анодные и катодные. Катодные покрытия производят металлами, электродный потенциал которых выше, чем у основного металла. Катодные покрытия создают механическую защиту основного металла благодаря его изоляции от внешней агрессивной среды. При нарушении сплошности покрытия происходит усиленная электрохимическая коррозия открытого участка основного металла. Поэтому применяют большую толщину катодных покрытий. Примером катодного покрытия является никелирование сплавов железа. Анодные покрытия производят металлами, электродный потенциал которых ниже, чем у основного металла. При таком покрытии происходит не только изоляция основного металла от внешней агрессивной среды, но и электрохимическая защита. При нарушении сплошности покрытия основной металл, который является катодом, не разрушается. Примером анодного является покрытие сплавов железа цинком.
Металлические покрытия наносят различными способами. При погружении в расплавленный металл поверхность изделия покрывается тонким и плотным слоем, затвердевающим после извлечения изделия. Этот способ применяется для нанесения покрытий цинком, оловом, свинцом и алюминием, температура плавления которых ниже, чем у защищаемого металла. При диффузионной металлизации изделие засыпают порошками алюминия, хрома, цинка и выдерживают при высокой температуре. При напылении поверхность изделия покрывают слоем расплавленного металла (цинка, алюминия, кадмия и др.) с помощью плазменной струи. При плакировании защищаемый металл подвергают совместной прокатке с защищающим (алюминием, титаном, нержавеющей сталью). Гальванический способ нанесения покрытий основан на осаждении под действием электрического тока тонкого слоя защитного металла (хрома, никеля, меди, кадмия) при погружении защищаемого изделия в раствор электролита. Припекание состоит в нанесении на защищаемый металл металлического порошка, который при спекании образует сплошной защитный слой и одновременно припекается к поверхности основного металла.
Неметаллические покрытия подразделяют на лакокрасочные, эмалевые, смоляные, покрытия плёночными полимерными материалами, резиной, смазочными материалами, керамические покрытия и др.
Лакокрасочные покрытия получили очень широкое распространение. Входящие в состав лакокрасочных покрытий плёнкообразователи обеспечивают высокую адгезию к металлам, получение сплошной, эластичной, непроницаемой плёнки, изолирующей металл от агрессивной среды. Недостатками этих покрытий являются снижение эффективности защиты со временем и обгорание при высоких температурах.
Покрытие резиной и эбонитом называют гуммированием. Его применяют для защиты химической аппаратуры от коррозионного действия кислот, щелочей и растворов солей.
Защита смазочными материалами производится при хранении и перевозке металлических изделий. При этом смазка периодически обновляется.
Особое место занимают покрытия, получаемые химической и электрохимической обработкой. Они превращают поверхностный слой изделия в химическое соединение, образующее сплошную защитную плёнку. Наибольшее распространение имеют оксидные и фосфатные защитные плёнки. Нанесение оксидных плёнок называют оксидированием, а на стали – воронением. Для воронения стали детали погружают в растворы азотнокислых солей при температуре 140 °С. Фосфатные покрытия наносятся при погружении в разбавленный раствор фосфорной кислоты и кислого фосфата цинка или магния. В результате на поверхности детали образуется плотная плёнка фосфатов железа.
Протекторная защитаоснована на подсоединении к защищаемому изделию протектора с более отрицательным электродным потенциалом. В агрессивной среде протектор будет являться анодом и постепенно разрушаться, а защищаемое изделие – катодом и разрушаться не будет. После полного разрушения протектор заменяется. Разница электродных потенциалов протектора и защищаемого металла не должна быть слишком большой, чтобы протектор не разрушался очень быстро. Обычно протекторы представляют собой пластинки, прикрепляемые к защищаемому изделию заклёпками или болтами. Для стальных изделий в качестве протекторов применяют сплавы цинка или магния. Например, подводные части судов (киль и винты) защищают цинковым протектором.
Для уменьшения агрессивности окружающей среды в неё в небольших количествах вводят химические соединения, называемые ингибиторами коррозии. Они значительно снижают скорость коррозии. Условием использования ингибиторов является эксплуатация изделия в замкнутой среде постоянного состава. Ингибиторы используют для защиты трубопроводов, теплообменных аппаратов, химической аппаратуры. Используют также бумагу, пропитанную ингибиторами. В неё заворачивают детали, подлежащие хранению или транспортировке.
Под жаростойкими (окалиностойкими) сталями понимают стали, обладающие стойкостью против химического разрушения поверхности при высокой температуре (свыше 550 °С). При нагреве стали происходит окисление поверхности и образуется оксидная плёнка (окалина). Дальнейшее окисление определяется скоростью проникновения атомов кислорода через эту плёнку. До температуры 570 °С окалина на железе состоит из оксидов Fe3O4 и Fe2O3. Они являются относительно плотными и скорость проникновения атомов кислорода через них не велика. При температуре выше 570 °С окалина состоит в основном из рыхлого оксида FeO. Через плёнку этого оксида атомы кислорода проникают очень легко и скорость окисления многократно возрастает.
Для повышения жаростойкости сталь легируют элементами, образующими плотную плёнку, через которую атомы кислорода не проникают. Эти элементы – хром, алюминий, кремний. Так как алюминий и кремний повышают хрупкость стали, чаще всего применяют хром в количестве до 30 %. Алюминий и кремний добавляются в хромистые стали в небольших количествах.

|
из
5.00
|
Обсуждение в статье: Диаграммы состояния сплавов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

