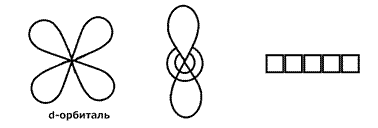|
Главная |
Теоретические основы неорганической химии
|
из
5.00
|
Е.И. Цыганова, Е.А. Гущина,
В.В. Медведева, В.Е. Лелеков
Х И М И Я
НЕОРГАНИЧЕСКАЯ И АНАЛИТИЧЕСКАЯ
Учебное пособие
для самостоятельной работы студентов
заочной формы обучения
Нижний Новгород
2018
УДК 541.(0.76.2)
Рецензент:
Зорин А.Д., доктор химических наук, профессор кафедры аналитической химии Нижегородского государственного университета им. Н.И. Лобачевского
Цыганова, Е.И. и др.
Химия неорганическая и аналитическая: учебное пособие для самостоятельной работы студентов заочной формы обучения/ Е.И. Цыганова, Е.А. Гущина, В.В. Медведева, В.Е. Лелеков. ФГБОУ ВО Нижегородская ГСХА – Н. Новгород, 2018. - 146 с.
Учебное пособие «Химия неорганическая и аналитическая» представлено лабораторно-практическими работами, полностью соответствующими задаче – научить студентов заочной формы обучения естественно - биологического сельскохозяйственного вуза навыкам и приемам химического эксперимента. В пособие включены задания для самостоятельной работы, уровни требований к знаниям студентов, а также формы контроля успеваемости.
Пособие предназначено для студентов - бакалавров заочной формы обучения агрономического, зооинженерного, ветеринарного факультетов (направление подготовки ветеринарно-санитарная дисциплина); факультета перерабатывающих технологий; почвоведения, агрохимии и агропочвоведения, факультета лесного хозяйства, а также студентов-специалистов ветеринарного факультета (квалификация - ветеринарный врач) на основании федеральных государственных образовательных стандартов высшего образования Министерства образования и науки Российской Федерации.
Печатается по решению редакционно-издательского совета Нижегородской государственной сельскохозяйственной академии.
© ФГБОУ ВО Нижегородская ГСХА
© Цыганова Е. И., Гущина Е.А., Медведева В.В., Лелеков В.Е.
ОГЛАВЛЕНИЕ
Введение. ………………………………………………………………………………….. 5 Варианты контрольных заданий…………………………. …………………………….8
1. Теоретические основы неорганической химии………………………………………13
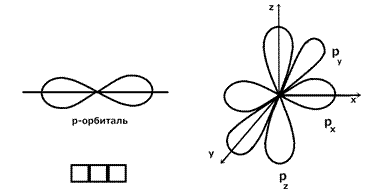
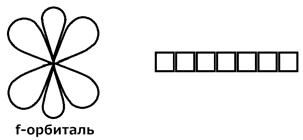
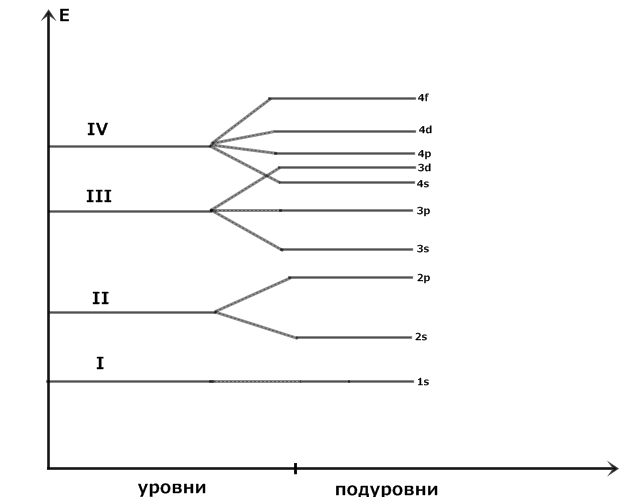
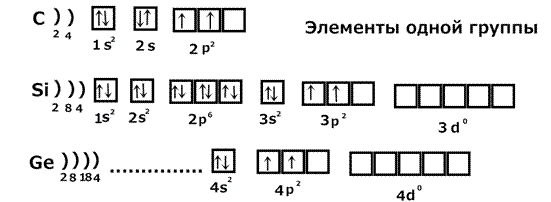
1.1. Периодический закон и периодическая система химических элементов
Д.И. Менделеева. Строение вещества. …………………………………………………..13
1.1.1. Контрольные задания 1-10 , 11-20 ……………………………………………….20
1 .2. Количественные расчеты в химии…………………………………………………21
1.2.1. Контрольные задания 21-30…………………………………………………………23
1.3. Классы и номенклатура неорганических соединений………………………………23
1.3.1. Методические указания и уровень требований к знаниям студентов по теме…. 28
1.3.2. Контрольные задания 31-40………………………………………………………….28
1.4. Равновесия в растворах электролитов………………………………………………...29
1.4.1. Способы выражения концентрации растворов……………………………………..30
1.4.2. Контрольные задания 41-50…………………………………………………………..34
1.4.3. Контрольные задания 51-60…………………………………………………………..35
1.4.4. Лабораторная работа №1. Приготовление растворов заданной концентрации
из более концентрированного путем разбавления ……………………………………...36
1.4.5. Равновесия в растворах электролитов. Электролитическая диссоциация………..38
1.4.6. Электролитическая диссоциация воды. Водородный показатель………………….43
1.4.7. Кислотно-основное равновесие в биосистемах. Буферные растворы.…………….46
1.4.8. Контрольные задание 61-70, 71-80…………………………………………………..50
1.4.9. Лабораторная работа №2. Свойства буферных растворов……………….................51
1.4.10. Гидролиз солей……………………………………………………………………… 53
1.4.11. Контрольные задания 81-90………………………………………………………... 58
1.5. Окислительно-восстановительные процессы (редокс-процесы)………………….....60
1.5.1. Методические указания по теме……………………………………………………...64
1.5.2. Контрольные задания 91-100……………………………………………………….....65
1.5.3. Лабораторная работа №3. «Окислительно-восстановительные процессы»............ 65
2. Химия биогенных элементов и их соединений……………………………………….... 68
2.1. Методические указания по теме………………………………………………………..68
2.2. Водород, кислород и их соединения. Контрольные задания 101-110………………..68
2.3. Азот и его соединения. Контрольные задания 111-120…………………………….....70
2.4. Фосфор и его соединения. Контрольные задания 121-130…………………………....73
2.5. Сера и ее соединения. Контрольные задания 131-140………………………………...77
2.6. Металлы – макроэлементы и их соединения. Контрольные задания 141-150……….79
2.7. Металлы-микроэлементы, тяжелые металлы и их соединения.
Контрольные задания 151-160…………………………………………………………………82
3. Аналитическая химия ……………………………………………………………………….85
3.1. Количественный анализ…………………………………………………………………...85
3.2.Титриметрический анализ………………………………………………………………….86
3.2.1. Расчеты в титриметрическом анализе…………………………………..........................86
3.3. Метод нейтрализации……………………………………………………………………...90
3.3.1. Примеры решения задач по теме «Метод нейтрализации»…………………………....94
3.3.2. Лабораторная работа «Стандартизация раствора кислоты по тетраборату натрия»... 96
3.3.3. Лабораторная работа «Определение содержания щелочи в растворе»……………….99
3.3.4. Лабораторная работа «Определение кислотности квашеных овощей………………..99
3.3.5. Уровень требований по теме «Метод нейтрализации»……………………………....100
3.3.6. Контрольные задания 161-170 (метод нейтрализации)………….................................101
3.4. Методы окислительно-восстановительного титрования (редоксметрия)……………103
3.4.1. Перманганатометрия ……………………………………………………………………104
3.4.2. Примеры решения задач по теме «Перманганатометрия»……………………………106
3.4.3. Лабораторная работа «Стандартизация раствора перманганата калия»……………..108
3.4.4. Лабораторная работа «Определение содержания железа в растворе»……………….109
3.4.5. Уровень требований по теме «Перманганатометрия»……………………………….. 109
3.4.6. Иодометрия……………………………………………………………………………….110
3.4.7. Примеры решения задач по теме «Иодометрия»………………………………………113
3.4.8. Уровень требований по теме «Иодометрия»…………………………………………...115
3.4.9. Контрольные задания 171-180 (метод редоксметрии)………………………………....115
3.5. Комплексонометрия …………………………………………………………………….118
3.5.1. Примеры решения задач по теме «Комплексонометрия»……………………………..123
3.5.2. Лабораторная работа «Определение общей жесткости воды»………………………..125
3.5.3. Лабораторная работа «Определение содержания цинка в растворе»………………...127
3.5.4. Уровень требований по теме «Комплексонометрия»………………………………….127
3.5.5. Контрольные задания 181-190 (комплексонометрия) …………………………………128
3.6. Гравиметрический анализ………………………………………………………………...130
3.6.1. Примеры решения задач по теме «Гравиметрический анализ»……………………….133
3.6.2. Контрольные задания 191-200 (гравиметрический анализ)…………………………...134
Литература……………………………………………………………………………………….137
Приложения……………………………………………………………………………………...138
ВВЕДЕНИЕ
Курс «Химия неорганическая и аналитическая» занимает основополагающее место в ряду фундаментальных химических дисциплин для подготовки специалистов высшего образования студентов естественно - биологического сельскохозяйственного вуза.
Курс профилирован - наибольшее внимание уделено изучению разделов, знание которых необходимо студентам - бакалаврам и специалистам заочной формы обучения ветеринарного, агрономического, зооинженерного факультетов, студентам факультета перерабатывающих технологий, почвоведения, агрохимии и агроэкологии, а также факультета лесного хозяйства, объектом профессиональной деятельности которых являются почвенные, агрохимические, агроэкологические исследования и разработки, направленные на рациональное использование и сохранение агроландшафтов при производстве продукции растениеводства и животноводства; контроль за состоянием окружающей среды и соблюдением экологических регламентов производства и землепользования; агроэкологическая оценка земель сельскохозяйственного назначения и обоснование методов их рационального использования; разработка экологически безопасных технологий производства продукции растениеводства и животноводства, воспроизводства плодородия почв, а также сельскохозяйственные, домашние, лабораторные, дикие и промысловые животные, птицы, пчелы, рыбы, гидробионты и другие объекты морского и речного промысла, клеточные культуры, микробиологические и вирусные штаммы, сырье и готовая продукция животного и растительного происхождения, корма и кормовые добавки, места их заготовки и хранения.
Предметом блока «Химия неорганическая и аналитическая» являются теоретические представления, составляющие фундамент химических знаний о свойствах биологически важных элементов и их соединений применительно к практическим задачам специалистов вышеперечисленных специальностей. Данное методическое пособие включает лабораторно-практические занятия, уровни требований к знаниям студентов заочной формы обучения, задания для самостоятельной работы, а также формы контроля успеваемости.
Цель дисциплины «Химия неорганическая и аналитическая» в подготовке студентов-бакалавров и специалистов заочной формы обучения состоит в том, чтобы дать им теоретические, методологические и практические знания, формирующие современную химическую основу для изучения профилирующих учебных дисциплин и выполнения в будущем основных профессиональных задач в соответствии с квалификацией.
Задачи дисциплины:
дать выпускникам заочной формы обучения вышеперечисленных факультетов определенный объем знаний по неорганической и аналитической химии для успешного усвоения последующих химических, общебиологических и специальных дисциплин учебного плана подготовки бакалавров по выбранной специальности;
показать связь химических наук с другими дисциплинами; показать роль неорганической и аналитической химии в развитии современного естествознания, ее значение для профессиональной деятельности специалиста;
привить студентам заочной формы обучения практические навыки, необходимые для будущей профессиональной деятельности в подготовке, организации, выполнении химического лабораторного эксперимента, включая использование современных приборов и оборудования, а также навыки грамотного и рационального оформления выполненных экспериментальных работ, обработки результатов эксперимента; навыки работы с учебной, монографической, справочной химической литературой.
Процесс изучения дисциплины «Химия неорганическая и аналитическая» направлен на формирование компетенцийв соответствии с ФГОС ВО и ООП ВО по направлениям подготовки бакалавров:
35.03.03 Агрохимия и агропочвоведение (Приказ Минобрнауки РФ № 1160 от 20.10.2015 г.);
38.03.07 Товароведение (Приказ Минобрнауки РФ № 1429 от 04.12.2015 г.);
35.03.04 Агрономия (Приказ Минобрнауки РФ № 1434 от 04.12.2015 г.);
35.03.07 Технология производства и переработки сельскохозяйственной продукции (Приказ Минобрнауки РФ № 1330 от 04.12.2015 г.);
35.03.08 Водные биоресурсы и аквакультура (Приказ Минобрнауки РФ № 1411 от 03.12.2015 г.);
36.03.02 Зоотехния (Приказ Минобрнауки РФ № 73 от 25.01.10 г.);
36.03.01 Ветеринарно-санитарная экспертиза (Приказ Минобрнауки РФ № 1516 от 01.12.2016 г.);
35.03.01 Лесное дело (Приказ Минобрнауки РФ № 1082 от 01.10.2015 г.), и направлению подготовки специалистов:
36.05.01 Ветеринария (Приказ Минобрнауки РФ № 962 от 03.09. 2015 г.).
Варианты контрольных заданий
Каждый студент выполняет контрольную работу в соответствии с вариантом задания, определяемого по двум последним цифрам шифра зачетной книжки студента, из таблицы. Например, шифр 353, последние цифры 53. Следовательно, студент в соответствии с цифрой 53 в левой колонке таблицы должен выполнить задания под следующими номерами: 3,13, 23, 33, 43, 53, 63, 73, 83, 93,103, 113, 123, 133, 143, 153, 163, 173, 183, 193.
При изучении первой части курса «Химия неорганическая и аналитическая» студент выполняет десять заданий, выбирая их из первого и второго блоков – «Теоретические основы неорганической химии» и «Химия биогенных элементов и их соединений». Выполняются контрольные задания из блока номеров 1-160.
При изучении второй части курса «Аналитическая химия биогенных элементов и их соединений» выполняются задания из номеров 161-200.
Доработка контрольной после проверки преподавателем является составной частью изучения материала. При доработке нет необходимости переписывать заново условия заданий и правильное решение других заданий. Вы должны выслать на рецензию ту же контрольную работу, в конце которой делаете дополнения в соответствии с замечаниями рецензента.
Варианты контрольных заданий