 |
Главная |
Периодическая система элементов Д.И. Менделеева.
|
из
5.00
|
МИНОБРНАУКИ РОССИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТОЕ
ОБРАЗОВАТЕЛЬНОЕ
УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ
УНИВЕРСИТЕТ ИМ.Р.Е.АЛЕКСЕЕВА»
(НГТУ)
Дзержинский политехнический институт (филиал)
Кафедра Химические и Пищевые технологии
Рассмотрено: Утверждаю:
на заседании МК Зам. Директора по учебной работе
Протокол №___от____________ ________________Г.В. Пастухова
Председатель МК__________ «___»__________________20 г
Электронные лекции
По дисциплине «Химия»
для студентов направления подготовки 15.03.02
Очная форма обучения
Подготовил: к.н. доцент
Лазарева Л.Г
Дзержинск, 2018 год
Содержание:
1. Строение атома
2. Периодическая система элементов Д.И. Менделеева
3. Общие свойства металлов
4. Электрохимия
5. Коррозия металлов
6. Термодинамика химических процессов
7. Элементы химической кинетики
8. Растворы
9. Химическая связь
10. Свойства некоторых s, p, d - металлов
Строение атома
| Открытие катодных лучей |
| Доказательства сложности строения атома |
| Явление фотоэффекта (1890) |
| Явление радиоактивности (1893) |
| Открытие периодического закона (1869) |
История развития теории строения атома
| Квантовая теория Н.Бора-Зоммерфельда 1913 г. |
| Квантово-механическая теория 20-ые годы ХХ в. |
| Планетарная модель Э. Резерфорда 1911 г. |
Квантово-механические представления о строении атома
Состояние микросистем нельзя описать, используя представления классической механики о перемещении тел (траектория, координата и т.д.). В 1925-26 гг. Гейсенберг и Шредингер разработали квантовую механику – науку о состоянии микросистем. Квантовая механика опирается на три положения :
1. Положение о квантовании энергии.
«Энергия распространяется, испускается и поглощается не непрерывно, а отдельными порциями – квантами». Это положение было высказано М. Планком в 1900 году при анализе атомных спектров нагретых тел. Энергия кванта Е= h υ= hc / λ. Атом каждого элемента имеет свой характерный спектр, состоящий из определённого набора линий или полос (полоса в свою очередь состоит из близкорасположенных линий), отвечающим определённым значениям длин волн. Рассмотрим возникновение наиболее простого спектра Н.

υ=R  -
- 
где : R - постоянная Ридберга
Серия Бальмера 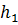 =2 ;
=2 ;  = 3,4...
= 3,4...
Поскольку каждая спектральная линия характеризуется строго определённой длиной волны λ , то это означает, что атомы могут излучать кванты света строго определённой энергии. Изучая квант света, атом переходит из одного энергетического состояния с энергией  :
:  =
= 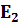 -
- 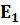 = hυ.
= hυ.
Отсюда следует, что энергия электрона в атоме изменяется дискретно, т.е. отдельными порциями – квантами.
2. Положение о волновом характере движения микрочастиц.
Эйнштейн установил, что электромагнитное излучение – это поток материальных частиц – фотонов, т.е. электромагнитному излучению характерен дуализм – двойственная корпускулярно – волновая природа. В 1924 г. д’Бройль распространил корпускулярно-волновые представления на все материальные частицы, т.е. движение любой материальной частицы – это волновой процесс, характеризующийся определённой длиной волны λ .
| длина волны фотона |
 = =  = = 
|
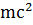 E=hυ, hυ=
E=hυ, hυ= 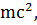 υ =
υ =  ,
,  =
= 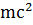 ,
,
По д’Бройлю  =
=  ;
;
где: m – масса;  – скорость движения любой материальной частицы.
– скорость движения любой материальной частицы.
Чев ↑ m, тем ↓  , т.е. дуализм актуален только для микрочастиц. Электрону с
, т.е. дуализм актуален только для микрочастиц. Электрону с 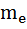 = 9 ∙
= 9 ∙  г, движущемуся со
г, движущемуся со  =1000 км/с, соответствует
=1000 км/с, соответствует  = -7,3 ∙
= -7,3 ∙  см=0,73 нм.
см=0,73 нм.
3. Положение о вероятном описании микрочастиц.
Квантовая механика отказывается от уточнения положения электрона в простран-стве атома. Неопределённость в положении и скорости электрона отражает принцип неопределённости Гейзенберга. «Невозможно одновременно определить положение микрочастицы (т.е. её координаты х,у,z) и её количество движения р=m∙v».
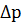 ∙
∙  ≥
≥ 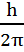
 ,
,  (
(  ) – (неопределённости) ошибки в значении р и (
) – (неопределённости) ошибки в значении р и (  ) положения микрочастицы.
) положения микрочастицы.
Если положение электрона в атоме определено с точностью  см, то ошибка в скорости составит 58000 км/сек .
см, то ошибка в скорости составит 58000 км/сек .
В квантовой механике существует своя терминология. Понятие движения электрона заменяют на состояние электрона.
Моделью состояния электрона является электронное облако. Чем прочнее связь электрона с ядром, тем меньше электронное облако по размеру и плотнее по распределению заряда. Область пространства, вокруг ядра, в которой наиболее вероятно пребывание электрона, называется орбиталью. Состояние электрона в квантовой механике описывают волновой функцией Ѱ – это математический аналог орбитали. В 1925-26гг. Шредингер вывел волновое уравнение, связывающее Ѱ с Е – энергией электронной системы.
| сумма вторых производных волн функции по координатам |
 ∙
∙  +
+ 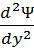 +
+ 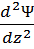 + uѰ = EѰ
+ uѰ = EѰ
| кинетическая энергия |
| полная энергия |
| потенц. энергия |
Точное решение только для атома : водорода (одноэлектронной системы). При решении уравнения Шредингера получают набор дискретных значений энергии электрона в атоме -  , -
, -  …
…  (точное решение). Для атома Н:
(точное решение). Для атома Н:  = -13,6
= -13,6  (эВ), где: n – целочисленные значения
(эВ), где: n – целочисленные значения
Значения энергии электрона в атоме получается со знаком «минус» , так как за состоянием с нулевой энергией принимают такое, когда электрон с кинетической энергией равной нулю, удалён от атома на бесконечно большее расстояние. При сближении электрона с ядром атома, энергия электрона уменьшается, т.е становится отрицательной, абсолютное значение которой растёт с ↓ расстояния между электроном и ядром.
 ∙ dV – плотность электронного облака в элементе объёма dV.
∙ dV – плотность электронного облака в элементе объёма dV.
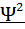 ∙ dV меняется от 0(
∙ dV меняется от 0(  =0- когда при движении электрон находится бесконечно далеко от ядра) до max. Если провести поверхность через точки max эл. плотности, то получится фигура, называемая формой электронного облака.
=0- когда при движении электрон находится бесконечно далеко от ядра) до max. Если провести поверхность через точки max эл. плотности, то получится фигура, называемая формой электронного облака.
При решении уравнения Шредингера пользуются полярной системой координат – r (расстояние частицы от центра системы координат).

В результате решения получают волновую функцию  в виде произведения трёх функций. Волновая функция при решении уравнения Шредингера получается как произведение трёх функций :
в виде произведения трёх функций. Волновая функция при решении уравнения Шредингера получается как произведение трёх функций :  =R (n,l) ∙ Θ(l,m) ∙ φ(m)
=R (n,l) ∙ Θ(l,m) ∙ φ(m)
↓
радиальная угловая составляющая
т.е поведение электрона в атоме определяется набором трёх чисел – n , l , m . Они получили название квантовых чисел.
Квантовые числа.
n – главное квантовое число – определяет энергию электрона и размер электронного облака, принимает целочисленные значения n =1,2...∞.Электроны с одинаковыми n образуют энергетический уровень (n=1, первый, самый близкий к ядру).
l – орбитальное квантовое число – определяет симметрию волновой функции, т.е. форму орбитали, принимает значения от 0 до n -1.
n= 1 2 3 4 – энергетический уровень
l= 0 0;1 0;1;2 0;1;2;3
форма s s p s p d s p d f
орб. О ∞ сложные
лепестковые
формы
Электроны с одинаковым l образуют энергетический подуровень – s,p,d,f.
m – магнитное квантовое число – определяет пространственную ориентацию орбитали несферической симметрии принимают значение от – l до + l
| l=0 m=0 |
| s-орбиталь в пространстве не ориентирована |
| l=1 (p-орбиталь) m= -1; 0; +1 |
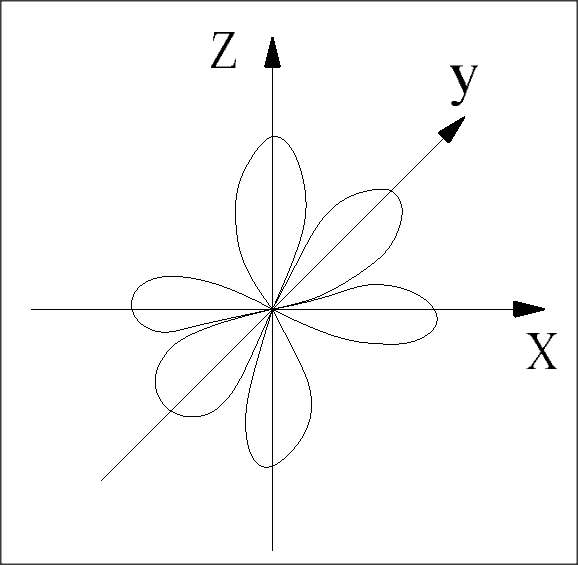
| отсюда в пределах одного энергетического уровня может быть не более 1s, 3p, 5d, 7f орбиталей |
m= -2; -1; 0; +1; +2
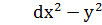 dxy dxy  dxz dyz dxz dyz
|
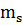 – спиновое квантовое число – упрощено характеризует движение электрона вокруг своей оси, имеет две ориентации
– спиновое квантовое число – упрощено характеризует движение электрона вокруг своей оси, имеет две ориентации 

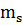 = ±1/2
= ±1/2  + 1/2
+ 1/2  (из уравнения Шредингера не рассчитывается). С помощью четырёх квантовых чисел можно описать состояние любого электрона в атоме. Для этого составляют электронные формулы атомов.
(из уравнения Шредингера не рассчитывается). С помощью четырёх квантовых чисел можно описать состояние любого электрона в атоме. Для этого составляют электронные формулы атомов.
Правила составления электронных формул атомов элементов.
1. Принцип наименьшей энергии: электроны располагаются на тех орбиталях в атоме, которые характеризуются наименьшей энергией.
По правилу Клечковского наименьшей энергией обладает орбиталь с наименьшей суммой квантовых чисел (n+l). При одинаковой сумме (n+l), наименьшей энергией обладает орбиталь с наименьшим n.
1s<2s<2p<3s<3p<4s<3d<<4p и т.д. <5s<4d<5p<6s<5d 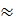 4f<6p<7s<6d
4f<6p<7s<6d
2.Принцип Паули: в атоме не может быть двух электронов, имеющих одинаковый набор четырёх квантовых чисел, т.е. орбитали (n,l,m – одинаковы) может находиться не более двух электронов с противоположными спинами ±1/2  . Отсюда на s-подуровне может max 2e, нар – 6е,d – 10e,f - 14e.
. Отсюда на s-подуровне может max 2e, нар – 6е,d – 10e,f - 14e.
3. Правило Хунда – суммарное спиновое число на подуровне должно быть максимальным, т.е. орбитали одного подуровня заполняются по одному электрону
↓ , затем по второму ↑ . 
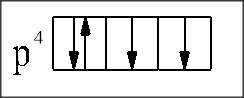 .
.
Пример: Записать электронную и электронно-графическую формулы атомов с пор.№16; 21 и их ионов
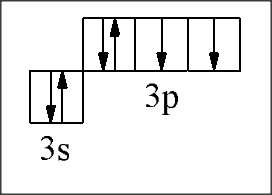
|
N=16, Z=+16, 16e. 1  2
2  2
2  3
3  3
3 
| эл. графич.формула (для графич. эл-нов) |
| вал. эл. |

|
 1
1  2
2  2
2  3
3  3
3  .
.
| вал. эл. |
 2
2  2
2  3
3  3
3  4
4  3d'
3d'
Sc – 3e →  1
1  2
2  2
2  3
3  3
3 
Элементы, в атомах которых заполняется s – орбиталь называются s – элементами, р – орбиталь р – элементами, d – электронами d –элементами, f – электронами f – элементами.
Сера – р – элемент, Sc – d – элемент.
Кроме основного состояния можно записать возбуждённое состояние атома (существует  -
-  сек). Валентные электроны с одного подуровня переходят на другой подуровень в пределах данного энергетического уровня.
сек). Валентные электроны с одного подуровня переходят на другой подуровень в пределах данного энергетического уровня.

|
 3
3  S*
S*
У некоторых d – элементов наблюдается перескок электронов.
| На самом деле |
| Должно быть |
 3
3  4
4  3
3  . При перескоке электронов обычно образуются наиболее
. При перескоке электронов обычно образуются наиболее
| Au |
| Ag |
 ,
,  ,
,  ,
,  ,
,  ,
,  – c наполовину или полностью заполненным подуровнем.
– c наполовину или полностью заполненным подуровнем.
| 6 пер. |
| 5 пер. |
| 4 пер. |
 = N 24, 29, 41, 42, 45, 46, 47 ... 78, 79 и у некоторых f – элементов.
= N 24, 29, 41, 42, 45, 46, 47 ... 78, 79 и у некоторых f – элементов.

Рис.1 Форма s-,p- и d – орбиталей.
Периодическая система элементов Д.И. Менделеева.
Формулировка периодического закона : свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра и электронной конфигурации атомов элементов.
Графическим изображение периодического закона является периодическая система, которая содержит 7 периодов (3 малых) и 8 групп. Физический смысл периодического закона заключается в периодическом изменении свойств элементов в результате периодически возобновляющихся сходных электронных оболочек атомов при последовательном возрастании значения главного квантового числа.
В группах расположены элементы с периодически повторяющейся электронной структурой внешнего энергетического уровня и похожими свойствами :
| Активные щелочные металлы |

| Металлич. активн. ↑ |

| Соединения с ионной связью |

K 4 
Rb 5 
 О, ЭОН обладают сильноосновн. свойствами
О, ЭОН обладают сильноосновн. свойствами
Cs 6 
Fr 7 
| Активные немет. (галогены) Неметаллич. акт ↓ Соединения чаще с ковалентным типом связи |
 n
n 
F 2  2
2 
CI3  3
3 
Br4  4
4 
I 5  5
5 
At 6  6
6 
| НГ-летучие вещества, в растворах Сильные кислоты (кроме HF) |
| d-элементы, металлы средней активности металлическая активность Соединения с ионно-ковалентным типом связи. Кислотно-основные соединения, свойства меняются в широких пределах MnO –основный, MnO2 –амфотерный. Mn2O1 – кислотный оксиды |

Mn 3  4
4 
Tc 4  5
5 
Re 5  6
6 
Каждый период (кроме 1-го) начинается с двумя s – элементами, заканчивается шестью р-элементами, причём в малых периодах свойства элементов изменяются резко.
| Li | Be | B | C | N | O | F | Ne | |||

| 2 
|
 2 2 
| 2  2 2 
| 2  2 2 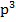
| 2  2 2 
|
 2 2 
| 2  2 2 
|
II период :
| Неметаллы,
неметаллич. активность ↑ |
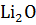 BeO
BeO 
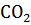

| Основные св-ва |
| Слабокислотные св-ва |
| Среднекислотные св-ва |
| Сильнокислотные св-ва |
| Амфотерные св-ва |
В IV периоде между s и р –элементами появляется десять d-элементов , а в VI и VII периодах f-элементы. D-элементы называются «переходными» , т.к. они являются металлами средней или низкой активности.
| K | Ca | Sc | Zn | Ga | Ge | As | Se | Br | Kr |
4 
| 4 
| 3  4 4 
| 3 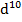 4 4 
| 
| 
| 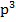
| 
| 
| 
|
IV период:
| Металлическая активность ↓ , но плавно (постепенно) |
Между электронной структурой атомов элементов и их положением в периодической системе существует тесная взаимосвязь.
Физический смысл:
1) Порядковый N элемента = Z его ядра и числу электронов в электронной структуре атома. Z=30 (Zn), 30e; 1  2
2  2
2  3
3  3
3  3
3  4
4  (d-элемент)
(d-элемент)
2) Каждый период начинается с заполнения нового энергетического уровня, поэтому Nпер.=главному квантовому числу внешнего энергетического уровня в электронной структуре атома элемента . 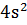 (ZN)-IV период
(ZN)-IV период
3) N группы совпадает с числом валентных электронов у атомов. У s и p элементов валентными являются электроны внешнего энергетического уровня. Sс 3  4
4  (VIA), а у d-элементов-электроны внешнего энергетического уровня + электроны
(VIA), а у d-элементов-электроны внешнего энергетического уровня + электроны
d – подуровня предвнешнего уровня. Sc 3  4
4  (IIIB). s, p элементы с числом валентных электронов >8. № 27,28,29,30,45,46 и др. (№27 Co 3
(IIIB). s, p элементы с числом валентных электронов >8. № 27,28,29,30,45,46 и др. (№27 Co 3  4
4  )
)
Периодически изменяющиеся свойства атомов элементов:
1) Радиусы атомов: Вследствие волнового характера движения электрона атом не имеет строго определённых границ. За орбитальный радиус  свободного атома принимают теоретически рассчитанное положение главного максимума плотности внешних электронных облаков.
свободного атома принимают теоретически рассчитанное положение главного максимума плотности внешних электронных облаков.

Вследствие экспериментальных трудностей определения орбитальных радиусов, чаще используют эффективные радиусы атомов и ионов, которые определяют из межядерных расстояний в молекуле или кристалле вещества. Этот радиус зависит от характера химической связи между атомами, менее точен; бывает r металлический ,
r контактный , r ионный , r благородные газы.
Для металлических элементов наблюдается удовлетворительное соответствие r орб. и r эфф. , а для неметаллических (особенно для благородных газов) они значительно различаются:
| Li | F | Ne | |
| r орб. (нм) | 0,157 | 0,39 | 0,33 |
| r эфф. (нм) | 0,155 | 0,64 | 1,12 |
В периодах слева направо радиусы атомов в целом уменьшаются из-за роста заряда их ядер, а в группах сверху вниз в целом растут из-за роста числа электронных слоёв, но в этой зависимости есть ряд особенностей. Например, она имеет немонотонный характер.

Объяснения немонотонности изменения радиусов связаны с особенностями электронного строения атомов. Например, для d-элементов в группах характерно лантаноидное сжатие за счёт заполнения электронами элементов в VI периоде
4f-орбитали:
| VIB: | Cr | Mo | W |
4  5 5 
| 4  5 5 
| 
| |
| r ат,нм | 0,127 | 0,139 | 0,140 |
Как видно,  и
и  практически одинаковы.
практически одинаковы.
Немонотонное изменение свойств элементов по периоду называется внутренней периодичностью, а по группе – вторичной периодичностью.
|
из
5.00
|
Обсуждение в статье: Периодическая система элементов Д.И. Менделеева. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

