 |
Главная |
Химические свойства металлов
|
из
5.00
|
Металлы довольно легко отдают свои валентные электроны, т.е. являются восстановителями Me – n → 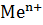 . Восстановительная активность свободных атомов металлов характеризуется энергией ионизации I : чем ниже I, тем выше восстановительная активность металла. В группах А (т.е. для s и р - металлов) восстановительная активность металлов растёт сверху вниз, а в группах В (т.е для d – металлов) как правило, уменьшается.
. Восстановительная активность свободных атомов металлов характеризуется энергией ионизации I : чем ниже I, тем выше восстановительная активность металла. В группах А (т.е. для s и р - металлов) восстановительная активность металлов растёт сверху вниз, а в группах В (т.е для d – металлов) как правило, уменьшается.
В растворах восстановительная активность атомов характеризуется значением электродного потенциала 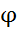 ˚ .Чем отрицательнее
˚ .Чем отрицательнее 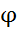 ˚ ,тем выше восстановительная активность металла. Самыми активными восстановителями являются атомы щелочных металлов.
˚ ,тем выше восстановительная активность металла. Самыми активными восстановителями являются атомы щелочных металлов.
| t |
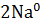 +
+ 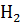 =
= 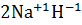 ,
, 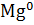 +
+ 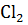 =
= 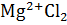 , Fe + S → FeS
, Fe + S → FeS
Гидрид хлорид сульфид
Большинство металлов, окисляясь на воздухе, покрываются плёнкой оксидов. Если плёнка плотная, она предохраняет металл от коррозии (т.е. разрушения на воздухе). На воздухе и окисляются только благородные металлы - Au, Pt.
Кроме оксидов на поверхности металлов могут образоваться и другие продукты взаимодействия с компонентами воздуха:
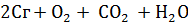 =
= 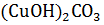 основной карбонат меди (II)
основной карбонат меди (II)
зеленый
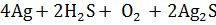 +
+ 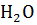 сульфид серебра
сульфид серебра
черный
Важными химическими реакциями являются реакции взаимодействия металлов с водой кислотами (HCl, 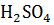 ,
, 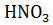 ), щелочами, растворами и солей.
), щелочами, растворами и солей.
Реакции с водой : металлы с 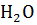 с вытеснителем
с вытеснителем 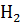 , если значение электродного потенциала меньше нуля, например:
, если значение электродного потенциала меньше нуля, например:
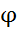 ˚
˚ 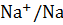 = -2,714 в, поэтому 2Na +
= -2,714 в, поэтому 2Na + 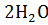 = 2NaOH +
= 2NaOH + 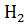
| t |
2Na + 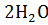 →
→ 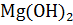 +
+ 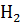
Для металлов, имеющих 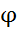 ˚
˚ 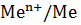 > 0 взаимодействие с водой термодинамически невозможно.
> 0 взаимодействие с водой термодинамически невозможно.
Реакции с растворами солей : металлы реагируют с растворами солей, вытесняя из них менее активный металл :
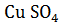 + Ni = Cu +
+ Ni = Cu + 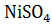
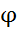 ˚
˚ 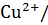 Cu = 0,337 в,
Cu = 0,337 в, 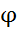 ˚
˚ 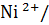 Ni = -0,25 в)
Ni = -0,25 в)
Обратная реакция :
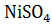 + Сu ≠
+ Сu ≠
термодинамически невозможна.
Реакции с щелочами : металлы реагируют с щелочами при двух условиях:
во – первых : реакция с щелочью протекает если электродный потенциал 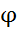 ˚
˚ 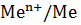 < 0
< 0
во – вторых : металл должен иметь амфотерную природу своих оксидов и гидроксидов. Данным условиям соответствуют такие металлы : Al, Zn, Cr, Be и др., например : 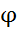 ˚
˚ 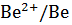 = - 1,847 в. Берилий образует амфотерные оксид ВеО и гидроксид
= - 1,847 в. Берилий образует амфотерные оксид ВеО и гидроксид 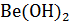 . Реакция с щелочью :
. Реакция с щелочью :
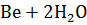 + 2 NaOH =
+ 2 NaOH = 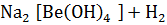
Реакции с кислотами : продукты взаимодействия металлов с наиболее важными минеральными кислотами зависят от активности металла, концентрации кислоты, температуры.
HCl : соляная кислота взаимодействует только с металлами электродный потенциал которых 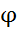 ˚
˚ 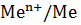 < 0 с выделением водорода :
< 0 с выделением водорода :
Zn + 2HCl = 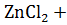
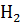 (Е˚
(Е˚ 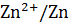 = - 0,763 в)
= - 0,763 в)
Сu + HCl ≠ (Е˚ 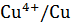 = 0,337 в)
= 0,337 в)
Если металл образует труднорастворимый хлорид, реакция идёт только на поверхности металла :
Pb+ 2HCl ≠ 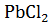 ↓ +
↓ + 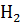
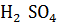 : разбавленная серная кислота реагирует с металлами также, как соляная :
: разбавленная серная кислота реагирует с металлами также, как соляная :
Zn + 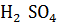 =
= 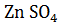 +
+ 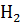 Cu +
Cu + 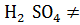
Pb + 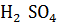 =
= 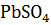 ↓ +
↓ + 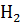
Концентрированная серная кислота окисляет металлы за счёт сульфат-иона, продукты восстановления зависят от активности металла до 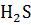 , с металлами средней активности до S, с неактивными до
, с металлами средней активности до S, с неактивными до 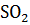 :
:
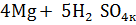 =
= 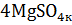 +
+ 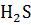 + 4
+ 4 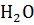
| t |
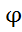 ˚
˚ 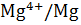 = -2,36 в – активный металл)
= -2,36 в – активный металл)
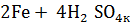 ===
=== 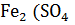
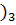 +
+ 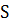 + 4
+ 4 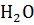
( 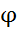 ˚
˚ 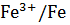 = -0,037 в – металл средней активности)
= -0,037 в – металл средней активности)
Реакция с Fe, а также с Be, Co, Ni, Al, Cr, идёт только при нагревании, т.к. серная концентрированная кислота пассивирует при обычной t эти металлы (т.е. образует на их поверхности плёнку оксидов).
Сu + 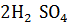 =
= 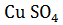 +
+ 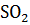 + 2
+ 2 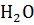
( 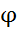 ˚
˚ 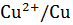 = 0,337 в – неактивный металл)
= 0,337 в – неактивный металл)
С наиболее активными d – металлами серная кислота не взаимодействует – Au, Pt – новые металлы – W,Ta, Nb, Hf.
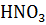 : разбавленная азотная кислота окисляет большинство металлов уже при обычной t, восстанавливаясь с активными Ме до
: разбавленная азотная кислота окисляет большинство металлов уже при обычной t, восстанавливаясь с активными Ме до 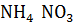 , с металлами средней активности до
, с металлами средней активности до 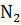 или
или 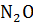 , с неактивными до – NO.
, с неактивными до – NO.
Концентрированная азотная кислота восстанавливается в реакциях с большинством металлов до бурого газа 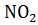 , она также, как серная концентрированная кислота, пассивирует при обычной t те же металлы :
, она также, как серная концентрированная кислота, пассивирует при обычной t те же металлы :
4Mg + 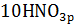 =
= 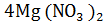 +
+ 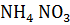 + 3
+ 3 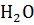
Mg + 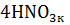 =
= 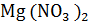
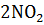 + 2
+ 2 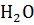
| t |
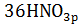 =
= 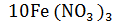 +
+ 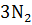 + 18
+ 18 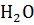
Fe + 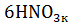 =
= 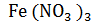 +
+ 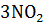 + 3
+ 3 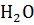
3Сu +  =
= 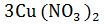 +
+ 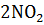 + 4
+ 4 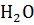
Сu + 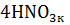 =
= 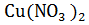 +
+ 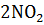 + 2
+ 2 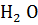
Наиболее неактивные d – металлы азотная кислота окисляет только в смеси с другими кислотами, например: смесь 1 объём 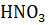 и 3 объёма HCl называется царской водкой
и 3 объёма HCl называется царской водкой
Au + 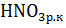 →
→
Au + 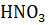 + 4HCl → H[Au
+ 4HCl → H[Au 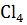 ] + NO + 2
] + NO + 2 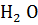
|
из
5.00
|
Обсуждение в статье: Химические свойства металлов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

