 |
Главная |
Электрохимические процессы
|
из
5.00
|
Это окислительно – восстановительные процессы, связанные с использованием или получением электрического тока.
Классификация электрохимических процессов
Химические источники тока (хит) Электролиз
Химическая энергия превращается в электрическую Электрическая энергия
превращается в химическую
Гальванические процессы Аккумуляторы
используется однократно, т.к. используется многократно,
протекает необратимая протекает обратимая окислительно-
окислительно-восстановительная -восстановительная реакция
реакция
Понятие об электродах. Уравнение Нернста
Электрод – это металл или другой токопроводящий материал, погруженный в раствор электролита, а реакция, протекающая на нём называется электродной реакцией. Например, если металл погрузить в раствор его соли, содержащий ионы металла - 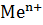 , получится металлический электрод. Если металл привести в контакт с раствором соли, то ионы-
, получится металлический электрод. Если металл привести в контакт с раствором соли, то ионы- 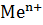 , гидратируясь, переходят с поверхности металла в раствор, и из раствора в металл под действием сил кристаллической решётки, а т.к. энергетическое состояние этих ионов различно, то скорость этих процессов неодинакова.
, гидратируясь, переходят с поверхности металла в раствор, и из раствора в металл под действием сил кристаллической решётки, а т.к. энергетическое состояние этих ионов различно, то скорость этих процессов неодинакова.

Когда υ1 = υ2 , на границе металл – раствор устанавливается равновесие:
Mе +  О ⇄
О ⇄  О + ne
О + ne
Zn + 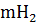 О ⇄
О ⇄ 
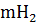 О + 2eˉ
О + 2eˉ
Образуется ДЭС (двойной электрический слой) и возникает равновесный электродный потенциал . Электродная реакция включат равновесие между окисленной (ОХ) и восстановленной (Red) формами. Система, содержащая такое равновесие, называется электрохимической системой.
Пример:
1.  + 2е ⇄
+ 2е ⇄  – металлический электрод
– металлический электрод 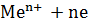 ⇄
⇄ 
2.  + 2е ⇄
+ 2е ⇄  – окислительно - восстановительный электрод
– окислительно - восстановительный электрод
Ок. форма ⇄ Вос. форма
(ОХ) (Red)
3.  + 2e ⇄
+ 2e ⇄ 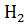 - газовый водородный электрод
- газовый водородный электрод

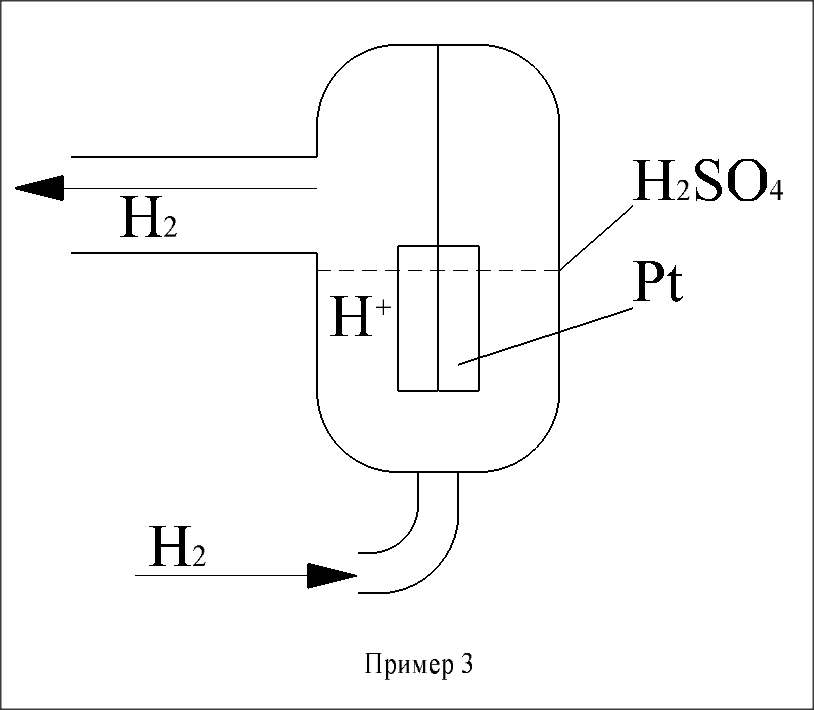
Пример 2 Пример 3
Цинковый (металлический) электрод называется активным, т.к. его материал участвует в электродной реакции, а материал электродов 2 и 3 является инертным и выполнен из пластин Pt и т.п. материалов. Такой электрод не участвует в электродной реакции, он только обеспечивает подвод и отвод электронов.
Значение электродного потенциала зависит от природы веществ – участников электродного процесса, от концентрации этих веществ, от Т и определяется по уравнению Нернста (обозначение электродного потенциала  ):
):
| Концентрация окисленной и восстановленной формы |
 =
=  + 2,3
+ 2,3  lg
lg 
 - стандартный электродный потенциал является табличной величиной.
- стандартный электродный потенциал является табличной величиной.
Подставляя R = 8,31  , F = 96500 К (число Фарадея), Т=298 К, получаем :
, F = 96500 К (число Фарадея), Т=298 К, получаем :
 =
=  +
+ 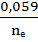 lg
lg 
где  - число электронов.
- число электронов.
Для металлических электродов  (восстановленная форма) - Ме, концентрация её является const и не включается в уравнение Нернста :
(восстановленная форма) - Ме, концентрация её является const и не включается в уравнение Нернста :
 =
=  +
+ 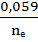 lg [Me ⁿ⁺]
lg [Me ⁿ⁺]
 =
= 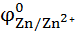 +
+  lg [
lg [  ⁺]
⁺]
Для окислительно-восстановительных электродов :
 =
= 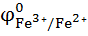 +
+  lg
lg 
Для водородного электрода 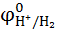 = 0 (условно принято). Такой электрод назвали нормальным водородным электродом (НВЭ), и он принят в качестве эталона для сравнения электродных потенциалов различных электрохимических систем:
= 0 (условно принято). Такой электрод назвали нормальным водородным электродом (НВЭ), и он принят в качестве эталона для сравнения электродных потенциалов различных электрохимических систем:
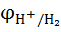 =
= 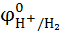 +
+  lg
lg  =
=  lg
lg  = 0,059lg
= 0,059lg  =-0,059 РНр ?0нциалов различных электрохимических систем:ктродом (НВЭ), и он принят в качестве эталона для сравнения электролдныхН .
=-0,059 РНр ?0нциалов различных электрохимических систем:ктродом (НВЭ), и он принят в качестве эталона для сравнения электролдныхН .
0 1
 - парциальное давление водорода.
- парциальное давление водорода.
Если в электродной реакции, протекающей в растворе принимают участие ионы (молекулы) среды, то их концентрация также влияет на значение f:
| Вос. форма |
| Ок. форма |
 +
+  ⇄
⇄ 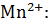
 О
О
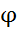
 /
/  =
=  /
/ 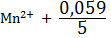 lg
lg 
Чем↑  , тем ↑ значение , т.е. значение электродного потенциала зависит от р ?0нциалов различных электрохимических систем:ктродом (НВЭ), и он принят в качестве эталона для сравнения электролдныхН . Для определения потенциала того или иного электрода нужно составить гальванический элемент из испытуемого и НВЭ электродов, измерить между ними разность потенциалов, это и будет
, тем ↑ значение , т.е. значение электродного потенциала зависит от р ?0нциалов различных электрохимических систем:ктродом (НВЭ), и он принят в качестве эталона для сравнения электролдныхН . Для определения потенциала того или иного электрода нужно составить гальванический элемент из испытуемого и НВЭ электродов, измерить между ними разность потенциалов, это и будет 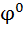 данного электрода. На практике в качестве электродов сравнения используют более удобные, чем НВЭ электроды, потенциалы которых в водородной шкале известны и стабильны. Например, хлоросеребряный электрод (ХСЭ). При замкнутой цепи на нём протекает реакция :
данного электрода. На практике в качестве электродов сравнения используют более удобные, чем НВЭ электроды, потенциалы которых в водородной шкале известны и стабильны. Например, хлоросеребряный электрод (ХСЭ). При замкнутой цепи на нём протекает реакция :
AgCl + e ↔ Ag + Cl¯
И его потенциал зависит от концентрации хлорид-ионов (  = 0,222 в). Рассчитать потенциал
= 0,222 в). Рассчитать потенциал 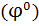 испытуемого электрода в водородной шкале можно по уравнению
испытуемого электрода в водородной шкале можно по уравнению
 = = 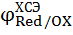 + 0,222 + 0,222
|
где  – искомый потенциал в водородной шкале,
– искомый потенциал в водородной шкале,
 – измеренный относительно ХСЭ.
– измеренный относительно ХСЭ.
Значение стандартных электродных потенциалов 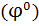 различных электродов в водородной шкале сведены в таблицу, в которой их располагают по возрастанию алгебраического значения
различных электродов в водородной шкале сведены в таблицу, в которой их располагают по возрастанию алгебраического значения  . Чем ↑ алгебраическое значение
. Чем ↑ алгебраическое значение  тем более сильными окислительными свойствами обладает окислительная форма, и чем ↓
тем более сильными окислительными свойствами обладает окислительная форма, и чем ↓  , более сильными восстановительными свойствами обладает восстановительная форма электрохимической системы.
, более сильными восстановительными свойствами обладает восстановительная форма электрохимической системы.
Пример: Сравнить восстановительные свойства металлов Fe, Cu, Zn
Восстановительная форма в данных системах – это металл, т.е. наименьшая алгебраическая величина  для Zn , т.е. в ряду Zn-Fe-Cu металлическая (т.е. восстановительная) активность убывает.
для Zn , т.е. в ряду Zn-Fe-Cu металлическая (т.е. восстановительная) активность убывает.
∆G окислительно – восстановительной реакции связано с электродным потенциалом по уравнению :
∆G = -nF∙ ∆, 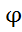
где ∆= 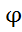 окисл.-
окисл.- 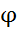 восст-ля,
восст-ля,
n – число электронов,
F – постоянная Фарадея.
Из уравнения следует, что ∆G < 0, если ∆G > 0, где ∆= 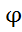 окисл.-
окисл.- 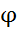 восст-ля , следовательно, критериям возможности окислительно – восстановительной реакции (ОВР) является неравенство :
восст-ля , следовательно, критериям возможности окислительно – восстановительной реакции (ОВР) является неравенство :
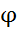 окислителя – окислителя – 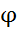 восстановителя > 0 восстановителя > 0
|
Пример:
| окислитель восстановитель |
 + Zn = Cu +
+ Zn = Cu + 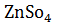
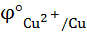 = 0,337 в >
= 0,337 в >  = - 0,763 в, т.е. критерий соблюдается, и реакция невозможна.
= - 0,763 в, т.е. критерий соблюдается, и реакция невозможна.
|
из
5.00
|
Обсуждение в статье: Электрохимические процессы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

