 |
Главная |
Электролиз расплавов и растворов электролитов
|
из
5.00
|
Электролизом называется окислительно –восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита.
В электрическую ванну, заполненную расплавом или раствором электролита опускают два электрода, химически устойчивые по отношению к электролиту, и присоединяют к источнику постоянного тока. Источник тока перекачивает электроны от одного электрода к другому (работает как насос). Электрод, с которого снимаются электроны, приобретает (+) заряд (анод), а тот, который получает электроны (-) заряд (катод).
На катоде идёт процесс восстановления, на аноде – окисления.
Процессы, протекающие при электролизе определяются свойствами – электролита, растворителя, электрода.
Если электролиз протекает в водном растворе, то на катоде и аноде могут восстанавливаться и окисляться молекулы  O – причем потенциалы этих процессов зависят от рН .
O – причем потенциалы этих процессов зависят от рН .
| рН | E°; в | рН | E°; в | ||
(-):2  O + 2е = O + 2е =  + 2ОН + 2ОН
| 14 | -0,82 | (+):А2  O - 4е = O - 4е =  + 4Н + 4Н
| 14 | 0,413 |
 = - 0,059 pH = - 0,059 pH
| 7 | -0,41 |  = 1,23 -0,059 pH = 1,23 -0,059 pH
| 7 | 0,815 |
| 0 | 0 | 0 | 1,23 | ||
Если возможно протекание нескольких электродных реакций, то в первую очередь протекает та, которая требует минимальных затрат энергии, т.е. на катоде идет процесс с большим алгебраическим значением потенциала, а на аноде – с меньшим алгебраическим значением потенциала.
Пример 1 : записать процессы, идущие при электролизе водного раствора  на инертных электродах.
на инертных электродах.
Инертным называется электрод, материал которого не претерпевает окисления в ходе электролиза (графит. Pt, Au)

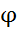 °; в
°; в
(-)К: Cu ² ⁺ + 2 e = Cu ° 0,337
2H₂O + 2е = Н₂ + 2ОН 0; -0,41; -0,82
(+)A: 2  + 2е = S ₂
+ 2е = S ₂ 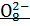 2,01
2,01
2Н ₂О - 4е = О ₂ + 4Н⁺ 1,23; 0,82; 0,41
рН 0 7 14
2CuSO₄ + 2H₂O → 2 Cu + O₂ + 2H₂SO₄
К А
На аноде может окисляться материал самого анода, например. если анод из Ni, Cu, Cd, Pb и др. Такие аноды называются растворимыми.
Пример 2 : Записать процессы, идущие при электролизе водного раствора CuSO₄ с С u – анодом
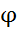 °; в
°; в
(-) К: тот же процесс, что в примере1
(+)A: 2  + 2е = S₂
+ 2е = S₂  2,01
2,01
2H₂O – 4е = О₂ + 4Н⁺ 1,23;
Cu -2 e = Cu ² ⁺ 0,337
2CuSO₄ + Cu → Cu + CuSO₄
К А
Метод с растворимым анодом используется для рафинирования металлов. Анод выполнен из чернового металла (т.е. загрязненного примесями).
Фактический потенциал. при которой идет электродная реакция, часто отличается от равновесного на некоторую величину. Явление отклонения потенциала электродной реакции от равновесного называется электрохимической поляризацией, а величина, на которую идёт отклонение – перенапряжением η (эта).
Возникновение поляризации связано с замедленностью отдельных стадий электрохимического процесса (подвод, отвод реагентов к электроду, собственно электродная реакция). Особенно велика поляризация при выделении газов - О₂ , Н₂. Поляризация электрода зависит от материала электрода и тем выше. чем больше плотность тока i = I /S (I – ток, проходящий через электрод, S – площадь электрода).
Зависимость потенциала электрода от плотности тока называется поляризационной кривой (рис.1).

 =
= 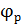 - η (сдвигается в (-) сторону)
- η (сдвигается в (-) сторону)
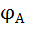 =
= 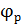 + η (сдвигается в (+) сторону)
+ η (сдвигается в (+) сторону)
Чем больше η, тем больше напряжение разложение U при электролизе, что приводит перерасходу электроэнергии.
U=  - ∆
- ∆  + I (
+ I (  +
+  )
)
| η омическое падение напряжения в проводниках |
ЭДС =  -
- 
U может быть снижено↓ сопротивления электродов и электролита, а также ↓ поляризации электродов.
Понизить поляризацию электродов можно увеличением концентрации электролита, ↑ Т, перемешиванием, ↑площади электродов, ↓силы тока.
Рассмотрим влияние поляризации на электродные реакции, идущие при электролизе. Рассмотрим электролиз водного раствора
 ZnCl₂ → Zn²⁺+ 2Cl¯
ZnCl₂ → Zn²⁺+ 2Cl¯
 ; в
; в
(-)К: Zn²⁺ + 2e = Zn -0,763
2Н₂О + 2е = H₂ + 2OН¯
pH 0 0
pH 7 -0,401 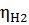
pH 14 -0,82
При малых i - Н₂ При больших i – Zn
 При pH =0;7 идёт процесс восстановления Н₂О; pH =14 Zn т.е. можно изменить процесс pH. Однако выделение Н₂ идёт с большим η , поэтому изменить процесс можно меняя i.
При pH =0;7 идёт процесс восстановления Н₂О; pH =14 Zn т.е. можно изменить процесс pH. Однако выделение Н₂ идёт с большим η , поэтому изменить процесс можно меняя i.
(-)А: 2Сl¯ - 2e = Cl₂ 1,36
2Н₂О + 4е = O₂ + 4Н¯ 1,23 pH 0
0,815 pH 7 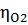
0,413 pH 14
pH не изменит процесс (должна окисляться Н₂О), но т.к. выделение O₂ идёт с большим η (  =
=  = 1,17 в), значительно больше Cl₂) то изменяя плотность тока, можно изменять электродный процесс :
= 1,17 в), значительно больше Cl₂) то изменяя плотность тока, можно изменять электродный процесс :
При очень малых i- O₂ При очень малых i- Сl₂
Обычно, при электролизе соляной кислоты и водных растворов ее солей-хлоридов на аноде выделяются не O ₂ , а Cl ₂
NaCl → Na⁺ + Cl¯, Н₂О
 ; в
; в
(-)К: Na⁺ + e →  -2,714
-2,714 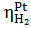 = -0,1 в
= -0,1 в
2Н₂О + 2e → Н₂ + 2OH¯ -0,82;( pH 14) - 
 = -0,78 в
= -0,78 в
(+)А: 2Сl¯ - 2e → Cl₂ 1,36
2Н₂О - 4e → О₂ + 4H⁺ 1,23 (pH 0) + 
 = 0,65 в
= 0,65 в
2NaCl + 2Н₂О → Н₂ + 2NaOH + Cl₂  = 1,17 в
= 1,17 в
К А
Законы Фарадея
1 закон : Масса вещества, образующегося при электролизе пропорциональна количеству электричества, прошедшему через электролит.
Э – эквивалентная масса
 = k ∙ Q, k =
= k ∙ Q, k =  =
=  – электрохимический эквивалент
– электрохимический эквивалент
М 96500Кл
Э = n (число электронов), F – число Фарадея = 26,8 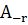
Q – количества электричества = I ∙ t – время (сек,час)
(сила тока)
 =
= 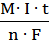
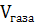 =
=  ,
,  – молярный объём газа
– молярный объём газа
если t = сек, F в Кл, t = час, F в 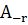
Из-за практических потерь, вещества при электролизе фактически образуются меньше, чем даёт теоретический расчёт по закону Фарадея :
 =
=  ∙ 100 % =
∙ 100 % = 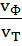 ∙ 100 % выход по току
∙ 100 % выход по току
 =
= 
 =
= 
2 закон : При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на одноименных электродах пропорциональны их эквивалентным массам.
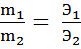
 ,
, 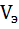 – эквивалентный объём
– эквивалентный объём
Применение электрохимических процессов
1. Принцип г.э. используется в автономных источниках питания электрическим током. Они делятся на первичные и вторичные. Первичные необратимы, не могут быть возвращены в рабочее состояние после расхода активного вещества (батарейки питания). Вторичные можно регенерировать, пропуская ток в обратном направлении (аккумуляторы).
2. Электролиз используется в промышленности
а) для получения Сl₂ , H₂ щелочей и др. веществ.
б) для получения многих металлов –Al, Mg, Na, Cd.
Если 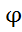 °
° 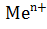 / Me <
/ Me < 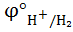 используют расплав соединения Ме, >
используют расплав соединения Ме, >  - раствор (Cu, Ni, Pb)
- раствор (Cu, Ni, Pb)
 = -0,82 (pH =14),
= -0,82 (pH =14),  = - 2,714 в (расплав NaCl)
= - 2,714 в (расплав NaCl)
 = -0,403 (раствор СdSO₄)
= -0,403 (раствор СdSO₄)
в) для очистки (рафинирование) Ме, используются загрязнённые Ме в качестве анода (Cu, Ni, Pb)
г) в гальванотехнике
гальваностегия – процесс нанесения на поверхность металлических изделий слоев других металлов. Это делают для защиты от коррозии и придания изделиям красивого вида. (Изделие – катод, а в растворе находятся ионы Cr³⁺ - хромирование, Ni²⁺ - никелирование)
гальванопластика – для получения отпечатков и копий изделий, служит например, для изготовления типографических клише.
Коррозия металлов
Коррозией называется самопроизвольное разрушение металлов, в результате их взаимодействия с окружающей средой. Коррозия бывает :
I. По характеру коррозионных разрушений:
1. Сплошная :
· Равномерная
· Неравномерная
· Избирательная, при которой разрушается одна структурная составляющая сплава.
2. Местная, охватывающая отдельные участки поверхности металла :
· Пятнами
· Точечная (питинговая, идет внутрь)
· Язвами
· Межкристаллитная (проходит по границам кристаллов и внешне не заметна)
· Транскристаллитная (или ножевая) идёт через зёрна кристаллов в виде трещин.
II. По условиям протекания :
· Газовая – в сухих газах
· Атмосферная
· Жидкостная – в среде не электролита или электролита
III. По механизму воздействия :
· Химическая
· Электрохимическая
· Биохимическая
· Струтурно-фазовая
Химическая коррозия, характерна для сред, не проводящих электрический ток. Происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды.
| t |
Для защиты от газовой коррозии используют также легирование металлов. В состав сплава входят компоненты (Cr, Al, Ni, Co, Si, W, Cu и др.) вызывающие пассивность металла. Такие сплавы обладают жаростойкостью и жаропрочностью.
Пассивность металла при легировании связана с тем, что легирующие добавки образуют при коррозии при коррозии плотные продукты реакции (Cr₂O₃, Al₂O₃ SiO₂ и тд.) предохраняющие сплав от дальнейшей коррозии. Жаростойкость – устойчивость к газовой коррозии при высоких температурах. Жаропрочность – способность сохранять высокую механическую прочность при высоких температурах.
Электрохимическая коррозия
Электрохимическая коррозия - протекает в растворах электролитов и сопровождается возникновением электрического тока. Электролит выполняет функцию проводника электрического тока. Наиболее простой моделью электрохимической коррозии является модель коррозионного гальванического элемента. На поверхности металла возникают катодные и анодные участки. Их возникновение связано с химической и геометрической неоднородностью поверхности металла – наличие шероховатостей, примесей других элементов. Катодные и анодные участки чередуются и имеют очень малые размеры, т.е. возникают микроаноды и микрокатоды и возникает коррозионный микроэлемент. Менее активные металлы, полированные участки поверхности, вкрапления соединений металла с неметаллами играют роль катодов, а более активные металлы, шероховатые участки поверхности – роль катодов. Металлы высокой чистоты с хорошо отполированной поверхностью коррозии практически не подвергаются. На аноде идёт процесс окисления. Вещества, обеспечивающие протекания катодных процессов, т.е. окислители, называются деполяризаторами. Если окислителем служит, растворённый в воде кислород, то протекает коррозия с кислородной деполяризацией.
| О₂+ Н₂О + 4e= 4OН (pH>7) | рН | 
| |
| О₂+ 4H⁺+ 4e= 2Н₂О (рН<7) | 14 | 0,413 в |  = 1,23...0,059 pH = 1,23...0,059 pH
|
| 7 | 0,815 в | ||
| 0 | 1,23 в |
Эти процессы протекают на катоде.
С кислородной деполяризацией протекает атмосферная, почвенная коррозия, коррозия в морской, речной воде. Иногда металлы корродируют с выделением Н₂ - в кислых растворах, в нейтральных растворах с активными металлами – Na, K, Mg. В этом случае коррозия протекает с водородной деполяризацией
| 2H⁺+ 2e= Н₂ (рН<7) | рН | 
| |
| 2Н₂О+ 2e= Н₂+2ОН | 7 | -0,41 | 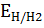 = - 0,059 pH = - 0,059 pH
|
| 14 | -0,82 | ||
Эти процессы протекают на катоде.
Рассмотрим электролитическую коррозию, стали : сталь состоит из кристалликов Fe, смешанных с зернами карбида Fe (или цементита Fe₃С и углерода). При соприкосновении с влажным насыщенным О₂ воздухом, на поверхности стали, образуется множество коррозионных микро гальвано-пар, где Fe – анод, а Fe₃С (или С)- катод.
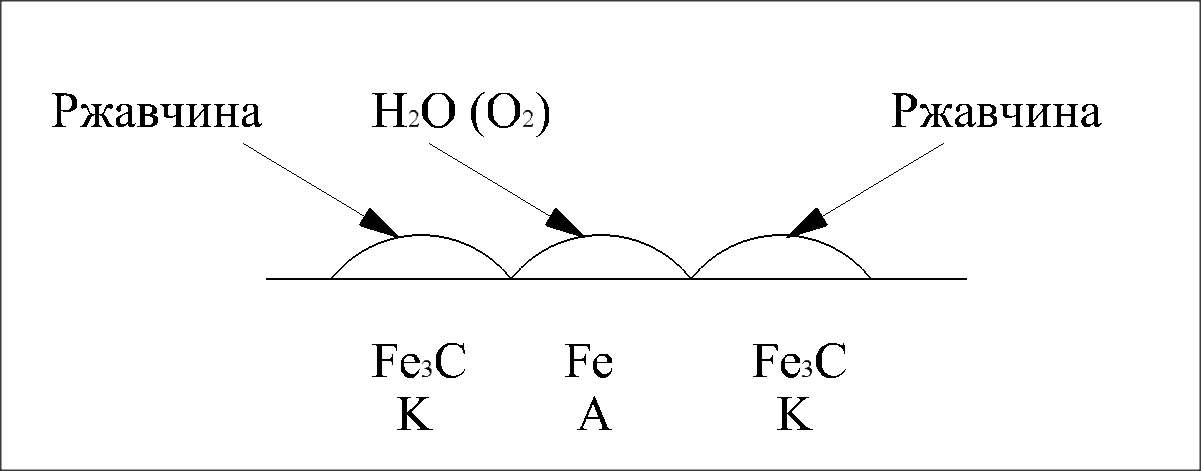
(-)А: Fe – 2t =  2
2
рН<7
(+)K: O₂ + 4H⁺ + 4e = 2H₂O 1 (-)Fe ⃒O₂ H₂O ⃒Fe₃C(+)
2Fe + O₂ + 4H⁺ = 2Fe²⁺ + 2H₂O
(-)А: Fe – 2e =  2
2
рН≥7
(+)K: O₂ +2H₂O+ 4e = 4OH 1
2Fe + O₂ + 2H₂O = 2Fe²⁺ + 4OH¯
2Fe(OH)₂ (Fe₂O₃*nH₂O) – ржавчина
4Fe(OH)₂ + O₂ + 2H₂O = 4Fe(OH)₃ - в дальнейшем.
Если металл содержит в виде примеси менее активный металл (находится с ним в контакте), то возникает контактная коррозия. Пример : алюминиевая заклёпка на медном листе во влажном воздухе.
 = -1,66 в
= -1,66 в
 = 0,337 в
= 0,337 в
Возникает коррозионная гальвано-пара, где Al – анод, Cu – катод:
(-)Al ⃒H₂O, O₂ ⃒Cu(+)
(-)А: Al – 3e = 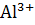 4
4
(+)K: O₂ +2H₂O+ 4e = 4OH¯ 3
4Al + 3O₂ + 6H₂O = 4Al³⁺ + 12OH¯
4Al(OH)₃
Коррозия как самопроизвольный процесс возможна, если ∆G<0, ∆G = -n ∙ F ∙∆E , где ∆E = ЭДС = 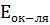 -
-  > 0. ∆E – термодинамическое условие протекания коррозии. Коррозия металла может протекать с различной скоростью. Наиболее часто скорость коррозии выражают через потерю массы металла в единицу времени (весовой показатель)
> 0. ∆E – термодинамическое условие протекания коррозии. Коррозия металла может протекать с различной скоростью. Наиболее часто скорость коррозии выражают через потерю массы металла в единицу времени (весовой показатель)

 = m₁ - m₂ - масса коррозируемого металла, t – время коррозии, S – площадь корродируемой поверхности металла. Иногда применяют объёмный показатель коррозии, если применяется объём коррозионной среды.
= m₁ - m₂ - масса коррозируемого металла, t – время коррозии, S – площадь корродируемой поверхности металла. Иногда применяют объёмный показатель коррозии, если применяется объём коррозионной среды.

При электрохимической коррозии применяют токовый показатель скорости коррозии, показывающий закономерность скорости коррозии от силы тока.

Факторы, влияющие на скорость коррозии.
I . Внутренние факторы.
Это природа металла, состояние его поверхности, его структура, наличие примесей, способность к пассивации – способность покрываться плотной плёнкой оксидов или других соединений. Наиболее коррозионно- стойки благородные металлы – Au, Pt, W, Zr, Hf, Ta, а наименее коррозионно-стойки щелочные металлы.
II . Внешние факторы.
1. Влияние рН среды . рН влияет на равновесные потенциалы катодных деполяризационных реакций
| рН | Кислородная деполяризация | Водородная деполяризация | ||

| Корродируемый Ме | 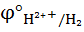
| Корродируемый Ме | |
| 0 | 1,23 | 
| 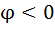
| |
| 7 | 0,815 | 
| 
| |
| 14 | 0,413 | 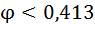
| 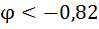
| |
Из таблицы следует, что наиболее коррозионно агресивны кислые среды, содержащие кислород в такой среде корродирует даже Ag).
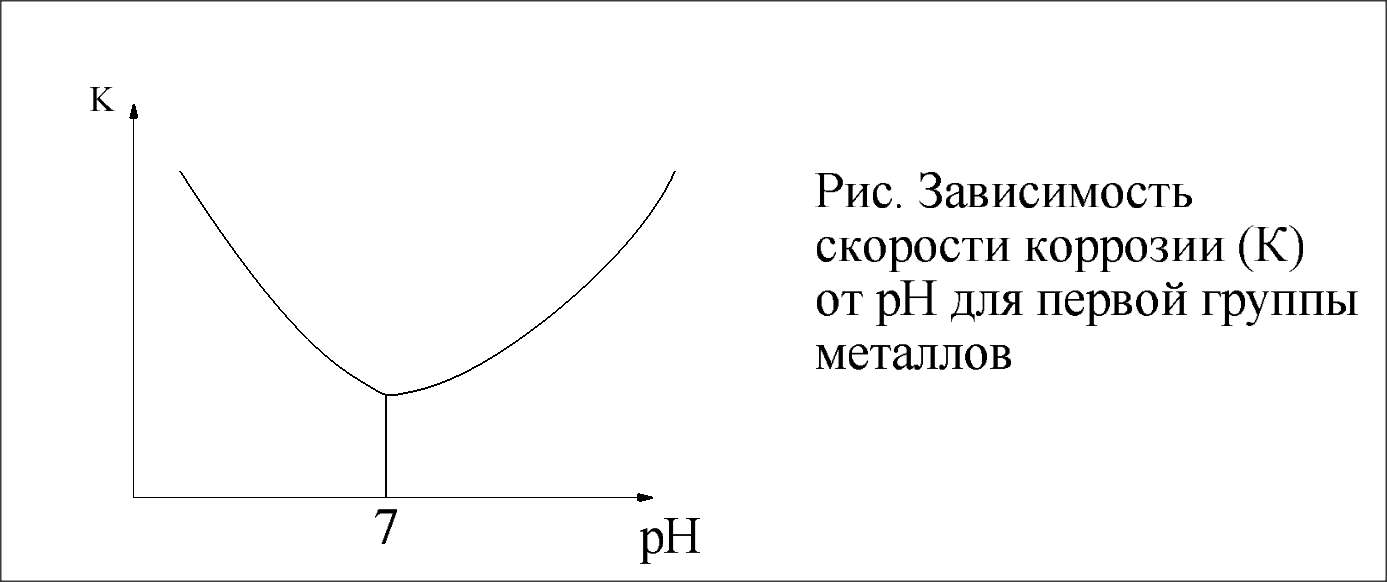
На зависимость скорости коррозии от рН влияет кислотно – основная природа оксидов и гидроксидов корродируемых металлов.
Различают четыре группы металлов:
1. Металлы оксиды и гидроксиды, которых обладают амфотерными свойствами :
Zn, Al, Cr, Pb, Sn и другие.
ZnO + HCl = ZnCl₂ + H₂O
ZnO + NaOH + H₂O = Na₂[Zn(OH)₄]
2. Металлы оксиды и гидроксиды, которых обладают основными свойствами : Са, Mg, Cd, Ni, Co и другие.
CaO + 2HCl = CaCl₂ + H₂O
CaO + NaOH ≠

3. Металлы оксиды и гидроксиды, которых коррозионно-стойкие во всех средах : Ag, Au, Pt.
MoO₃ + NaOH = N₂MoO₄ + H₂O
MoO₃ + HCl ≠

2. Температура, как правило, увеличивает скорость коррозии, т.к. увеличивает скорость диффузии и растворимость деполяризатора и продуктов коррозии. По-разному влияет на скорость анодных и катодных процессов, и обязательно изучается экспериментально.
3. Состав коррозионной среды. Вещества, входящие в состав коррозионной среды могут, как увеличивать, так и уменьшать скорость коррозии. Изменяющие скорость анодного процесса, т.е. окисление самого металла – это анодные ускорители или замедлители коррозии. А вещества изменяющие скорость катодного процесса – катодные ускорители или замедлители коррозии.
3а. Соль, подвергающаяся гидролизу в коррозионной среде изменяет рН раствора и влияет на скорость анодного процесса.
Na₂SO₃ + HOH = NaOH + NaHCO₃ , рН>7
У металлов первой и третьей группы скорость коррозии выше, в данном случае соль анодный ускоритель. У металлов второй группы скорость коррозии уменьшается, соль анодный замедлитель коррозии.
3б. Соль образует с металлом или продуктами его коррозии плёнку малорастворимых соединений. Это пассивирует металл и уменьшает скорость коррозии – это анодный замедлитель коррозии.
PbO + Na₂SO₄ = PbSO₄↓ + Na₂O
3в. Соль содержит в своём составе поверхностно-активные ионы.
F¯ Cl¯ Br¯ I¯
Эти анионы, адсорбируясь на оксидной плёнке металла, внедряются в нёё замещая ионы кислорода, разрушают защитную плёнку, т.е. увеличивают скорость коррозии – анодные ускорители коррозии.

3г. Наличие в растворе веществ, связывающих ионы корродируемого металла в комплексный ион, резко увеличивает скорость коррозии – это анодные ускорители коррозии.
NH₃(NH₄OH) NaOH (OH)¯
Медь, которая не корродирует в воде, быстро корродирует в растворе аммиака
2Cu + O₂ + 8NH₄OH = 2[Cu(NH₃)₄] (OH)₂ -6H₂O
Увеличение скорости коррозии связано с тем, что комплексообразование уменьшает электродный потенциал металла и увеличивает его восстановительную активность
 = 0,337 в
= 0,337 в
 = 0,04 в
= 0,04 в
3Д. Скорость коррозии зависит от скорости восстановления деполяризатора, которая лимитируется скоростью диффузии, чем выше скорость коррозии, тем меньше перенапряжения восстановления деполяризатора. Перенапряжение η зависит от природы металла, на котором идет восстановление деполяризатора.
 = -1,24 в
= -1,24 в
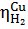 = -0,8 в
= -0,8 в
 = -1,41 в
= -1,41 в
Из-за большого перенапряжения Zn медленно вытесняет из разбавленной соляной кислоты водород.
Zn + 2HCl = H₂ + ZnCl₂
Но если привести в контакт с медью, на которой перенапряжение выделения водорода меньше, Zn начинает активно разлагать соляную кислоту.
 = 0,763 в
= 0,763 в
 = 0,337 в
= 0,337 в
(-)А: Zn – 2e = 
(+)K: 2H⁺+ 2e = H₂
Если привести Zn в контакт с ртутью, на которой перенапряжения выше чем на цинке, то скорость коррозии цинка уменьшится.
 = 0,854 в
= 0,854 в
Медь – катодный ускоритель коррозии
Ртуть – катодный замедлитель коррозии.
3е. Если в растворе есть вещества способные пассивировать корродируемый металл путем создания на нем защитной пленки соединения, то скорость коррозии металла уменьшается – это анодные замедлители коррозии.
Замедляют коррозию вещества способные поглощать кислород – катодные замедлители коррозии.
Методы защиты от коррозии.
· Легирование
· Защитные покрытия
· Изменения коррозионной среды
· Электрохимическая защита
· Рациональное конструирование
При легировании в состав сплава входят легирующие элементы (Cr, Ni, Co, W и др.)Химические покрытия представляют собой защитные плёнки, полученные путём превращения поверхностного слоя металла в химическое соединение. Наиболее распространены оксидные плёнки и процессы их образования – оксидирование.
Образование малорастворимых фосфатов – фосфатирование, сульфата – сульфатирование. Так же бывают неметаллические и металлические покрытия. Неметаллические – эмаль, керамика, лакокрасочное покрытие – недолговечно не на все металлы. Металлические покрытия – катодные и анодные.
Катодные покрытия (  – потенциал) Анодные покрытия
– потенциал) Анодные покрытия




Луженое железо Sn/Fe Оцинкованное железо Zn/Fe
При повреждении металлического покрытия анодное покрытие будет защищать металлическую основу, а катодное – не будет.
Метод пригоден для случаев, когда защищаемое изделие эксплуатируется в ограниченном объёме (химические аппараты, системы охлаждения)
Уменьшить концентрацию деполяризации можно :
· Введением восстановителей Na₂SO₃, N₂H₄
· Подщелачиванием ↓ [H⁺]
· Введение в коррозионную среду ингибиторов коррозии.
Механизм действия ингибиторов заключается в абсорбции ингибиторов на корродируемую поверхность с последующим торможением катодных или анодных процессов.
Электрохимические методы подразделяются на протекторные и катодные. Протекторная защита заключается в том, что к корродируемому металлу присоединяют более активный металл – протектор. Образуется коррозионная гальвано-пара, в которой защищаемый металл будет катодом. Применяется для защиты морских судов, в качестве протектора служит цинк. Катодная защита заключается в том, что защищаемый металл присоединяют к отрицательному полюсу внешнего источника тока, т.е. делают его катодом, а дополнительный электрод – анодом. Анодом может служить любой металл – кусок старой трубы или рельса. Используется для защиты трубопроводов.
Рациональное конструирование заключается в том, что сокращают или исключают число и размеры особо опасных с точки зрения коррозии участков конструкции (сварных швов, щелей, контактов разнородных металлов и т.п.)
|
из
5.00
|
Обсуждение в статье: Электролиз расплавов и растворов электролитов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

