 |
Главная |
Физические свойства оснований.
|
из
5.00
|
Гидроксиды щелочных металлов – при обычных условиях представляют собой твердые белые кристаллические вещества, гигроскопичные, мылкие на ощупь, очень хорошо растворимы в воде (их растворение – экзотермический процесс), легкоплавки. Гидроксиды щелочноземельных металлов Са(ОН)2, Sr(OH)2, Ва(ОН)2) – белые порошкообразные вещества, гораздо менее растворимы в воде по сравнению с гидроксидами щелочных металлов. Нерастворимые в воде основания обычно образуются в виде гелеобразных осадков, разлагающихся при хранении. Например, Сu(ОН)2 – синий студенистый осадок.
Химические свойства оснований. Заполните таблицу.
Таблица 6 – Химические свойства оснований
| Щелочи | Нерастворимые основания |
|
| |
|
| |
Лабораторная работа № 10.
Генетическая связь между классами неорганических соединений
Цель работы:
- учиться правильно, пользоваться химическими реактивами и химической посудой;
- учиться работать самостоятельно, организованно, аккуратно.
- закрепить навыки составления химических реакций по теме: «Генетическая связь между классами неорганических соединений»;
- повторить основные химические свойства неорганических соединений.
Теоретическая часть
С веществ одного класса можно получить вещества другого класса.
Такая связь между классами неорганических соединений называется генетической. Рассмотрим его более подробно.
Из простых веществ можно получить сложное вещество, например:
2Ca + O 2 = 2CaO
Из сложного вещества можно получить простые вещества, например:
2H2 O  2H2 + O2
2H2 + O2
Из металла реакцией горения можно получить основной оксид, который с водой образует основу. При воздействии на основу кислотой реакцией нейтрализации можно получить соль.
Рассмотрим такую генетическую связь на примере металла бария.
Составим схему:
Ba 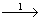 BaO
BaO 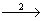 Ba (OH)2
Ba (OH)2 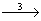 Ba3 (PO4)2
Ba3 (PO4)2
Составим уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
1) 2Ba + O2 = 2BaO
2) BaO + H2 O = Ba (OH)2
3) 3Ba (OH)2 + 2H3 PO4 = Ba3 (PO4)2 ¯ + 6H2 O
Реакцией горения из неметалла можно получить кислотный оксид, который с водой образует кислоту. При действии на кислоту реакцией нейтрализации можно получить соль. Рассмотрим такую генетическую связь на примере неметалла фосфора.
Составим схему:
P 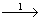 P2 O5
P2 O5 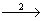 H3 PO4
H3 PO4 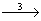 Ba3 (PO4)2
Ba3 (PO4)2
Составим уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
1) 4P + 5O2 = 2P2 O5
2) P2 O5 + 3H2 O = 2H3 PO4
3) 2H3 PO4 + 3Ba (OH)2 = Ba3 (PO4)2 ¯ + 6H2 O
Приведенные выше схемы генетических связей можно представить в общем виде следующей схеме:
металл → основной оксид → основание → соль
неметалл → кислотный оксид → кислота
Практическая часть
| Осуществить превращения: Zn SO4 →Zn Cl2 → Zn(OH)2 → Zn(NO3)2 →Zn S |
| -Осуществить превращения: KOH →K2 SO4 →KCl → KNO3 |
Творческое задание
|
из
5.00
|
Обсуждение в статье: Физические свойства оснований. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

