 |
Главная |
Ионообменное равновесие
|
из
5.00
|
Ионный обмен - обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами. Обычно одна из этих фаз ионит, а другая раствор электролита [1].
Если ионит, содержащий только противоионы А, поместить в раствор, содержащий только противоионы В, то ионы А начнут замещаться ионами В из раствора. Через некоторое время установится равновесие: ионит и раствор будут содержать ионы обоих сортов в определенном соотношении. Такое состояние называется ионообменным равновесием[2].
Ионный обмен является обратимой химической реакцией. В соответствии с этим, должно, достигаться состояние равновесия, удовлетворяющее закону действующих масс.
RA + В+ ↔ RB + А+,
где R — матрица ионита с присоединенным к ней фиксированным ионом, А+ и В+ — подвижные ионы[3].
Ионообменное равновесие обусловлено концентрацией раствора, свойствами ионита и обменивающихся ионов, а также температурой. Селективность ионного обмена проявляется в различии абсолютных значений коэффициентов распределения ионов 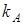 и
и 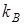 , которые для рассматриваемого равновесия можно определить как
, которые для рассматриваемого равновесия можно определить как
 и
и  (1),
(1),
где 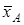 и
и 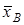 - эквивалентные доли ионов А+ и В+ в ионите,
- эквивалентные доли ионов А+ и В+ в ионите,  и
и  - в растворе.
- в растворе.
Деля  на
на  , получим коэффициент селективности, или константу обмена
, получим коэффициент селективности, или константу обмена  , которая, зависит от концентрации обменивающихся ионов:
, которая, зависит от концентрации обменивающихся ионов:
 (2).
(2).
Введя поправки на коэффициенты активности ионов в растворе  и
и  , получают уточненный коэффициент селективности
, получают уточненный коэффициент селективности 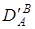
 (3).
(3).
Следует отметить, что постоянство значений уточненного коэффициента селективности сохраняется только при данной степени замещения. С изменением  величина
величина  изменяется. В таких случаях рассчитывают истинную константу обмена:
изменяется. В таких случаях рассчитывают истинную константу обмена:
 (4).
(4).
Поскольку определение  затруднительно, предлагается избрать стандартное состояние ионита в А- и В- формах, в котором
затруднительно, предлагается избрать стандартное состояние ионита в А- и В- формах, в котором  и
и  равны единице.
равны единице.
Истинная константа равновесия обмена разновалентных ионов с зарядами  и
и 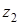 выражается уравнением Никольского:
выражается уравнением Никольского:
 (5),
(5),
соответствующая взаимодействию эквивалентного числа ионов ионита и раствора:

На основе теоремы Больцмана Никольский показал, что соотношение коэффициентов активности ионов в твердой фазе не меняется, если свободная энергия их взаимодействия со средой остается постоянной. С известным приближением такое положение справедливо при замещении одного противоиона в ионите на другой, и это позволяет пользоваться для расчета констант обмена уравнением, аналогичным уравнению (3), в котором активности ионов в твердой фазе заменены их концентрациями:
 (6),
(6),
где 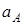 и
и  - активности катионов с зарядами
- активности катионов с зарядами 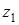 и
и 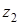 в растворе;
в растворе;  и
и  - концентрации противоионов в твердой фазе, выражаемые в экв на 1 кг или в, мг-экв на 1 г сухого ионита.
- концентрации противоионов в твердой фазе, выражаемые в экв на 1 кг или в, мг-экв на 1 г сухого ионита.
|
из
5.00
|
Обсуждение в статье: Ионообменное равновесие |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

