 |
Главная |
Статистический смысл понятия - энтропия.
|
из
5.00
|
Вероятностное толкование понятия энтропии было дано в статистической физике Людвигом Больцманом. Для этого было введено понятие термодинамической вероятности (W) данного состояния некоторой системы. Термодинамическая вероятность означает число возможных неотличимых микроскопических состояний системы реализующих определенное макроскопическое состояние этой системы.
Рассмотрим простую систему всего из двух неотличимых молекул, находящихся в некотором объеме. Мысленно разделим этот объем на две части, и, пронумеровав молекулы, найдем число способов, которым можно разместить их в этих двух частях (Рис. 4.7).

Рисунок 4.7.
Как видно из рисунка, всего таких способов будет четыре, но два нижних неотличимы, так как молекулы 1 и 2 совершенно одинаковы, и соответствуют одному и тому же макроскопическому состоянию системы. Таким образом, мы имеем три различных макроскопических состояния системы, номера которых обозначены слева на рисунке. Два верхних макросостояния реализуются только одним способом, а третье, нижнее двумя. Число способов и является термодинамической вероятностью W, величина которой приведена справа от рисунков. Все четыре способа равновероятны, поэтому большую часть времени система будет находиться в третьем состоянии. Вероятность p (на рисунке ее значения приведены справа от W) - конкретного макроскопического состояния определяется отношением числа способов, которым можно реализовать это состояние W к общему числу возможных способов размещения молекул. Первые два макросостояния более упорядоченные - в них мы можем выделить две области, в одной есть молекулы, в другой - нет. Третье макросостояние менее упорядоченное, так как мы не можем выделить таких областей. Это означает, что вероятность нахождения системы в менее упорядоченном макроскопическом состоянии больше, чем в упорядоченном.
Мы рассмотрели только 2 молекулы. Число способов размещения n молекул в двух частях объема равно 2n, а число способов размещения всех молекул в одной половине объема равно 1. Из этого следует, что вероятность нахождения всех молекул в одной половине объема p = 1/2n. При большом числе молекул (в одном моле газа n = 6·1023) вероятность упорядоченного состояния, когда все молекулы соберутся в одной половине становится практически равной нулю. Таким образом, чем большим числом способов может быть реализовано определенное макроскопическое состояние системы (или, что одно и то же, чем больше термодинамическая вероятность W этого состояния), тем менее оно упорядоченное и наиболее вероятное. Энтропия термодинамического состояния системы определяется через термодинамическую вероятность как: S = k·lnW, где k – постоянная Больцмана. Это выражение энтропии через термодинамическую вероятность получило название "принцип Больцмана".
В статистической термодинамике энтропия не только функция состояния системы и физическая величина, характеризующая направленность процессов в природе, но и мера беспорядка и хаоса. В изолированных системах все реальные процессы (например, расширение газа, диффузия, теплопередача) протекают в сторону увеличения энтропии. В результате этих процессов система приходит в состояние термодинамического равновесия, и ее макроскопические параметры (V, P, T) перестают меняться. В этом состоянии энтропия системы достигает максимального значения. Поэтому состояние термодинамического равновесия изолированной системы можно определить, как состояние с максимальным значением энтропии, или с максимальной величиной хаоса.
Лабораторная работа № 10. Порядок выполнения работы.
Задание. Энтропия.
Ознакомьтесь с теоретической частью работы.
Откройте рабочее окно.
А). Нажмите кнопку Пуск и запустите движение частиц. Из-за перегородки частицы будет только в правой части объема, поэтому на графике это будет соответствовать максимальному отклонению от равномерного распределения частиц в двух половинах объема или упорядоченному состоянию в целом. Удалите перегородку и через некоторое время нажмите клавишу Стоп, а затем Пуск, чтобы очистить третью колонку таблицы. Пронаблюдайте за графиком отклонения распределения частиц от равномерного распределения. Дождитесь, когда график заполнит все окно и движение частиц остановится. Из третьей колонки таблицы выпишите время нахождения системы в состояниях с распределением частиц 0:2; 1:1 и 2:0 (первая цифра число частиц слева, вторая - справа) и общее время наблюдения T. Снова нажмите кнопку Пуск и повторите эту процедуру 2 - 3 раза. По проведенным измерениям, найдите среднее время tсред. нахождения системы в каждом из трех состояний.
Различные состояния системы могут осуществляться с той или иной вероятностью. Вероятность i -го состояния pi определяется как предел отношения времени ti , в течение которого система находится в данном состоянии, к полному времени T наблюдения над системой при неограниченном увеличении T .
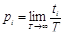
При ограниченном времени наблюдения T , отношение ti / T называют относительной частотой ( hi ), которую используют для оценки соответствующей вероятности.
Разделив tсред. на общее время наблюдения, рассчитайте относительную частоту hi нахождения системы в каждом из трех состояний и заполните таблицу:
| Состояние | 0:2 | 1:1 | 2:0 |
| tсред. | |||
| hi |
Оцените вероятность нахождения системы в этих состояниях и сравните полученный результат с данными приведенными в теоретической части. Какое состояние из трех состояний наименее упорядоченное и наиболее вероятное?
Б). Задайте число частиц равное 4. Повторите то же самое, что и в пункте А, но уже для 4-х частиц. После удаления перегородки подождите, пока частицы не распределятся во всем объеме, и не забудьте нажать клавишу Стоп, а затем Пуск, чтобы очистить третью колонку таблицы. Заполните таблицу:
| Состояние | 0:4 | 1:3 | 2:2 | 3:1 | 4:0 |
| tсред. | |||||
| hi |
Как изменилась, по сравнению с предыдущим случаем, вероятность того, что все частицы будут находиться в одной половине объема? Используя формулы в теоретической части, найдите эту вероятность и сравните с приведенным в таблице значением. Используя относительную частоту состояния 2:2 из заполненной вами таблицы, оцените число способов (или термодинамическую вероятность W), которым можно реализовать это состояние.
В). Задайте число частиц равное 8. Повторите то же самое, что и в предыдущих заданиях, но уже для 8-ми частиц. После удаления перегородки подождите, пока частицы не распределятся во всем объеме, и не забудьте нажать клавишу Стоп, а затем Пуск, чтобы очистить третью колонку таблицы. Заполните таблицу:
| Состояние | 0:8 | 1:7 | 2:6 | 3:5 | 4:4 | 5:3 | 6:2 | 7:1 | 8:0 |
| tсред. | |||||||||
| hi |
Используя относительную частоту состояния 4:4 из заполненной вами таблицы, оцените число способов (или термодинамическую вероятность W), которым можно реализовать это состояние.
Г). Задайте число частиц равное 16. Повторите то же самое, что и в предыдущих заданиях, но уже для 16-ти частиц. После удаления перегородки подождите, пока частицы не распределятся во всем объеме, и не забудьте нажать клавишу Стоп, а затем Пуск, чтобы очистить третью колонку таблицы. Заполните таблицу:
| Состояние | 0:16 | 1:15 | 2:14 | 3:13 | 4:12 | 5:11 | 6:10 | 7:9 | 8:8 | 9:7 | 10:6 | 11:5 | 12:4 | 13:3 | 14:2 | 15:1 | 16:0 |
| tсред. | |||||||||||||||||
| hi |
Используя относительную частоту состояния 8:8 из заполненной вами таблицы, оцените число способов (или термодинамическую вероятность W), которым можно реализовать это состояние. На основании табличных данных постройте график, на котором по горизонтальной оси отметьте через равные промежутки все возможные состояния системы от 0:16 до 16:0, а по вертикальной, соответствующую этим состояниям вероятность.
Д). Сравните между собой все рассмотренные случаи. Как меняется вероятность нахождения данной системы в упорядоченном состоянии с увеличением числа частиц? Почему, с точки зрения вероятностного подхода, когда мы убираем перегородку, газ, содержащий большое количество частиц занимает весь объем и не может самопроизвольно собраться в одной половине? Когда в этом случае система в целом находится в более упорядоченном состоянии до удаления перегородки или после? Как при этом меняется энтропия системы? Возможен ли самопроизвольный переход изучаемой системы на некоторое время в упорядоченное состояние в случае малого количества частиц (например, 2-х)? Можно ли в этом случае говорить о законе возрастания энтропии или он проявляется только для систем с большим количеством частиц?
Е). В рассматриваемых случаях объем газа после удаления перегородки увеличивался в два раза. Термодинамическая вероятность W~VN, где V - объем, а N -число частиц. Найдите изменение энтропии для случая 16 частиц при расширении газа. В процессах смешения двух газов, расширении газа после удаления перегородки или в процессе теплопередачи, вначале в системах можно выделить отличающиеся части: один газ - другой газ; есть газ - нет газа; более горячая - менее горячая. В конце этих процессов выделить отличающиеся части нельзя. На этих примерах поясните, почему энтропия является мерой беспорядка и хаоса? Мы нагреваем лед, он тает, охлаждаем воду - она замерзает. Отрытые это системы или нет? Как меняется степень упорядоченности и энтропия в первом и во втором случае? Сделайте вывод о том, как может меняться энтропия в открытых системах? Человек сжигая бензин в двигателе автомобиля, преобразует энергию хаотического теплового движения в упорядоченное механическое движение автомобиля. С другой стороны органический углерод, содержащийся в бензине, окисляется до углекислого газа и разлетается в атмосфере, кроме этого, и большая часть тепловой энергии передается окружающей среде. Увеличивается при этом энтропия или уменьшается в целом, включая окружающую среду. Как хозяйственная деятельность человека влияет на биосферу?
|
из
5.00
|
Обсуждение в статье: Статистический смысл понятия - энтропия. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

