 |
Главная |
Типы изомерных отношений в органической и неорганической химии
|
из
5.00
|
Первый широко распространенный тип изомерии — так называемая структурная изомерия. В этом случае изомеры отличаются друг от друга порядком соединения атомов в молекуле и расположением ординарных двойных и тройных связей между атомами. Легко представить себе изомеры органических производных углеводородов, содержащих кислород и другие гетероатомы. Пример такой изомерии — ацетальдегид и его енольная форма:


 O
O
CH3 — C CH2 =CH — OH
 енол
енол
H
Ацетальдегид
Следует отметить, что структурная изомерия присуща не только органическим соединениям. Вот несколько примеров: синильная кислота HCN и её изоформа HNC, фульминат серебра (гремучекислое серебро) AgCNO и цианат серебра AgOCN. Особенно показательно осуществленное в 1828 году Велером превращение «неорганического» цианата аммония NH4NCO в «органическую» его мочевину.[1]
Большое значение имеет структурная изомерия в координатной химии. Частный случай такой изомерии — гидратная изомерия, когда комплексные соединения отличаются числом молекул воды, входящих во внутреннюю сферу, т. е. непосредственно связанных атомами металла. При растворении в воде хлорида хрома (III) образуется несколько соединений. Установлено, что в молекуле фиолетового комплекса ион хрома координирован (связан) сразу с шестью молекулами воды, а в темно-зеленом к иону хрома присоединены одновременно четыре молекулы воды и два атома хлора, в то время как хлорид-ион и две молекулы воды располагаются на внешней сфере:
H2O Cl









 H2O H2O H2O H2O
H2O H2O H2O H2O





 Cr Cl3 Cr Cl٠2H2O
Cr Cl3 Cr Cl٠2H2O
H2O H2O H2O H2O
H2O Cl
Фиолетовый темно-зеленый
Второй тип изомерии — геометрическая изомерия. Она характерна для молекул, в которых каждый атом связан с одинаковыми для каждого изомера соседями. Но относительное расположение этих соседей в пространстве различно. Простейший пример геометрической изомерии — цис-, транс-изомерия органических соединений, содержащих двойную связь. В молекуле 1,2-дихлорэтена оба атома углерода, соединенные двойной связью, имеют одинаковых соседей: каждый из них связан с атомом водорода и атомом хлора. Но вот ориентация двух атомов хлора в пространстве для цис -, трансизомеров различна:



 Cl Cl Cl H
Cl Cl Cl H


 C=C C=C
C=C C=C
 H H H Cl
H H H Cl
цис-изомер транс-изомер
Геометрическая изомерия существует и в неорганической химии. Так, в комплексе двухвалентной платины с двумя атомами хлора и двумя молекулами аммиака молекулы аммиака могут располагаться в пространстве двумя различными способами, образуя цис- или транс-изомеры:



 NH3 Cl NH3 Cl
NH3 Cl NH3 Cl

 Pt Pt
Pt Pt

 NH3 Cl Cl NH3
NH3 Cl Cl NH3
цис-изомер транс-изомер
(оранжевый) (желтый)
Обратим внимание: различить пространственные изомеры по свернутым (не структурным) формулам невозможно. Необходимо либо графически показывать геометрию комплекса (как это сделано выше), либо указывать тип изомера, например: транс-1,2-дихлорэтен.
Как структурные, так и геометрические изомеры обладают различными физическими и химическими свойствами. Среди физических свойств в этом плане, прежде всего следует отметить температуры плавления и кипения. Кроме того, изомеры могут иметь различную окраску. Наибольшие различия в химических свойствах проявляют, разумеется, изомеры с различными функциональными группами (так, химические свойства этанола резко отличаются от свойств изомерного ему диметилового эфира).
Третий тип изомерии — оптическая изомерия, которая выражается тем, что в двух изомерах каждый атом имеет одинаковых соседей, расположенных в одинаковой последовательности. Все различие заключается в том, что для одного изомера эта последовательность может быть получена при обходе заместителей какого-либо атома по часовой стрелке, а для другого — против. Так, если в молекуле метана заместить три атома водорода какими-либо другими различными группами, например метильной, карбоксильной и аминогруппой, можно получить оптические изомеры аминокислоты аланина, в которых один атом углерода имеет четыре различных заместителя.

Эти изомеры нельзя совместить. Но оптические изомеры (их называют также оптическими антиподами) совмещаются, если один из них отражен в зеркале. Отсюда вытекает условие существования оптической изомерии: каждый такой изомер при отражении в зеркале дает структуру, которая не может быть совмещена со структурой этого изомера, но является структурой второго изомера.
Наличие в молекуле атома углерода, связанного с четырьмя различными заместителями,— достаточное условие существования оптической изомерии. Однако можно представить себе много случаев, когда в молекуле нет такого, как говорят, ассиметричного атома углерода, а вещество тем не менее может быть разделено на два оптических антипода. Для этого должно выполняться лишь одно условие, при котором изображение молекулы в зеркале не совпадает с самой молекулой. Приведем два примера. Первый взят из координационной химии: комплекс кобальта, содержащий две молекулы этилендиамина H2N-CH2-CH2-NH2 и два атома хлора, приводит к двум оптическим антиподам, структуры которых как бы связаны зеркальной плоскостью.
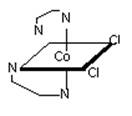


В молекуле гексагелицена нет ассиметрических углеродных атомов, но спираль этой молекулы может быть закручена вправо или влево. В зависимости от этого соединение существует в виде одного или другого оптического изомера.
В отличие от структурных и геометрических изомеров свойство оптических антиподов очень близки. Различать их можно лишь по одному физическому параметру — направлению вращения плоскости поляризации света. Оказывается, если пропустить через раствор оптического антипода плоскополяризованный свет, его плоскость несколько повернется вправо или влево, причем раствор противоположного антипода повернет эту плоскость в другую сторону. Химические свойства оптических антиподов очень схожи, в большинстве случаев неразличимы. Однако если действовать на оптические изомеры реагентами, которые также являются оптическими антиподами, отличие в реакционной способности может стать заметным. Оптические антиподы играют огромную роль в биохимических процессах, где почти все реагенты существуют в виде одного из антиподов. Ускоряющие биохимические процессы ферменты, как правило, оказывают действие только на строго определенные оптические изомеры. Известно, например, что организм усваивает аминокислоту или сахар лишь одной оптической формы.
Четвертый тип изомерии — топологическая изомерия. Сюда относятся изомеры, имеющие одинаковую формулу, но различающиеся взаимным положением в пространстве двух или нескольких частей молекулы. Самый простой пример: система «кольцо в кольце», называемая катенаном. Один из изомеров — два никак не связанных между собой кольца — существенно отличается от другого изомера — двух переплетенных колец.

Другой пример топологической изомерии — система «атом в клетке». Атом какого-либо металла или маленькая молекула «сидит» в клетке, построенной, например, из групп -CH2, и не может из неё выбраться по той же причине, по которой птица не может вылететь из клетки.

Топологическим изомером системы «атом в клетке» является простая смесь атомов металла (существующих либо в виде диспергированных частиц металла, либо ионов металла, находящихся в растворе) и чисто органических молекул, построенных в форме «клетки». До сих пор такая система не получена и синтез этого вещества представляет огромные трудности.
Мы говорили в основном лишь о таких изомерах, переход которых друг в друга вызывает определенные трудности. Почти во всех случаях для перевода одного изомера в другой необходимо очень прочную углерод-углеродную связь и затем соединить атомы в другом порядке. Но известны изомеры легко переходящие друг в друга. Для такого перевода молекуле нужно лишь слегка повернуть группировки вокруг простой связи С—С. Получающиеся изомеры называются конформерами, а взаимные переходы конфармационными.

На рисунке показаны три наиболее устойчивых конформера 1,2-дихлорэтана. При этом нужно отметить, что наибольшей стабильностью обладает конформер, или, как еще говорят, поворотный изомер, в котором атомы хлора расположены на максимальном расстоянии друг от друга. Дело в том, что при этом взаимное отталкивание двух громоздких атомов хлора минимально. Конформационная изомерия может быть выделена в особый, пятый тип изомерии.
Мы уже коснулись возможности взаимных переходов изомеров в так называемой кетоенольной системе на примере ацетальдегида и его енольной формы. Однако содержание енола в смеси изомеров в этом случае незначительно. Если же взять ацетилацетон, в котором метиленовая группа зажата между двумя карбонильными группировками, то протон этой метиленовой группы довольно легко отщепляется и присоединяется к атому кислорода. Образуется енольная форма, содержание которой достигает в смеси нескольких процентов. Такое явление, связанное с обратимым динамическим переходом какого-либо атома от одной группировки молекулы к другой, в результате чего в смеси находятся в равновесии две изомерные формы соединения, называется таутомерией. Приведем две таутомерные формы ацетилацетона:



 CH3—C—CH2—C—CH3
CH3—C—CH2—C—CH3


O O
кетон

 CH3—C = CH—C—CH3
CH3—C = CH—C—CH3

OH O
енол
Необходимо подчеркнуть, что разобранный выше случай динамической изомерии — таутомерия — не относится к самостоятельному типу. Ведь здесь два таутомера — кетон и енол — являются структурными изомерами, различающимися расположение атомов и связей в молекуле.
|
из
5.00
|
Обсуждение в статье: Типы изомерных отношений в органической и неорганической химии |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

