 |
Главная |
Изомерия в органической химии
|
из
5.00
|
В органической химии, в отличие от неорганической, явление изомерии приобретает особенно большое значение.
У соединений углерода, как было уже ранее указано, одна и та же молекулярная формула отвечает на одному, а нескольким соединениям, различающимися по химическим и физическим свойствам. Это явление было открыто давно. В 1830 году Берцелиус дал ему название «изомерия»[2]. Даже у сравнительно простых соединений углерода существуют многочисленные изомеры. Так, например, известно свыше 20 различных веществ состава С2Н12О2, которые резко отличаются по химическим и физическим свойствам и иногда принадлежат к различным классам; некоторые из них — кислоты (масляная и изомасляная), другие — нейтральные вещества (например, диоксан). Составу С6Н12О2 отвечают 80 веществ, описанных в литературе. Подобных примеров можно привести бесчисленное множество.
Теория химического строения Бутлерова позволила правильно объяснить причины изомерии.
Рассматривая явление изомерии, Бутлеров указывает, что при одном и том же молекулярном составе порядок связей атомов в молекулах изомеров различен: «Единственно только некоторым различием этого отношения (различием способа связи) и можно объяснить явления изомерии».
Иными словами, различие в порядке связей в молекуле и являются причиной изомерии.
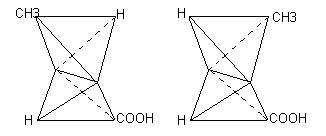
Если изобразить при помощи двух тетраэдров пространственное расположение атомов в молекуле масляной кислоты, то мы получим модель, представленную на рисунке


В этой модели в центре обоих тетраэдров находятся атомы углерода метиленовых групп СН2. Если вращать один из тетраэдров вокруг линии, соединяющей их центры, то можно получить любое число пространственных положений атомов одного тетраэдра относительно атомов другого тетраэдра. Два эти положения изображены на рисунке.
Таким образом, казалось бы, для масляной кислоты возможна изомерия. Однако ни у нормально масляной кислоты, ни у других подобным образом построенных соединений не наблюдается такого рода «поворотных» изомеров. Это легко объяснить, если принять предложенный Вант-Гоффом принцип свободного вращения атомов по ординарной связи.
Не следует, однако, считать, что такое вращение действительно совершенно свободно. Рассмотрим, например молекулу дихлорэтана.

Атомы С—С, связаны простой связью, соединены с атомами водорода и хлора, которые при повороте вокруг линии С—С испытывают в большей или меньшей степени взаимное притяжение или отталкивание. Это приводит к тому, что молекула принимает некоторое пространственное положение («конформацию»), которое в этих условиях будет наиболее устойчивым, например как на данном рисунке, где однородные атомы располагаются в наиболее удаленных положениях. Существование такого рода заторможенного вращения было доказано оптическими и другими физическими методами, особенно при изучении поведения вещества при низких температурах.
Открыто также много случаев, когда поворот по ординарной связи вовсе не может произойти из-за помех, обусловленных большими размерами близко расположенных атомов и групп. В этих случаях, например у производных дифенила (С6Н5— С6Н5), поворотные изомеры выделены в устойчивых формах.
Совершенно другая картина получается, если два атома углерода связаны двойной связью.
Рассмотрим этот случай на примере кротоновой кислоты.
Для получения молекулы кротоновой кислоты надо от молекулы масляной кислоты отнять два атома водорода; освобождающиеся при этом валентные связи насыщают друг друга. На тетраэдрической модели это изображают, складывая тетраэдры по ребру.
Такое расположение атомов делает невозможным свободное вращение, так как для этого необходим разрыв связей. Водородные атомы молекул кротоновых кислот могут находиться или по одну сторону от плоскости, проходящей через углеродные атомы и двойную связь, или же на различных её сторонах. Для обозначения первого положения перед названием изомера ставится приставка цис-. Второе расположение обозначается приставкой транс-.
Цис - и транс - изомеры кротоновых кислот схематично можно изобразить следующим образом:

цис-изомер транс-изомер
Другим примером цис-транс-изомерии могут служить олеиновая и элаидиновая кислоты. 
цис-изомер транс-изомер
олеиновая кислота элаидиновая кислота
Теорию этого вида изомерии разработал в 1887 году Вислиценус, исходя из тетраэдрической модели Вант-Гоффа.
Изучение химических свойств обоих изомеров позволяет для каждого из них выбрать определённую конфигурацию.
Цис- или транс-конфигурации во многих случаях можно установить и на основании величины дипольных моментов.
Цис-изомеры 1,2-дигалоидных производных этилена должны иметь дипольный момент; транс-изомеры (при одинаковых атомах галоида) не могут иметь дипольного момента вследствие внутренней компенсации положительных и отрицательных зарядов:

цис-дихлорэтилен транс-дихлорэтилен
Чрезвычайно интересны взаимоотношения между цис- и транс- изомерами непредельных кислот. Один из этих изомеров (например, кротоновая или же эладиновая кислоты) более устойчив, чем другой (кислоты изокротоновая или же олеиновая). Не устойчивый изомер (лабильная форма) при нагревании или воздействии некоторых веществ (H2SO4, KOH, HNO2) может переходить в устойчивую (стабильную) форму. Это превращение идет быстро в присутствии брома или йода на прямом солнечном свету. Обратное превращение может происходить при действии ультрафиолетовых лучей или же может быть осуществлено при помощи ряда химических реакций.
Заключение
Мир органических молекул многообразен и неисчерпаем, как многообразна и многогранна в своих проявлениях природа, живая и неживая, познанная нами и еще не познанная. Это бесконечное разнообразие создается благодаря тому, что атомы могут связываться в различной последовательности, по разному располагаясь в пространстве, образуя цепи разнообразной формы, кольца и т. п. Такие молекулы, взаимодействуя между собой, могут в свою очередь образовывать так называемые макромолекулы. В зависимости от того, сколько и каких малых молекул (молекул мономера) участвует в построение макромолекулы, как она располагается в пространстве относительно других макромолекул и как взаимно ориентированы в пространстве её части, какие молекулы «вспомогательных» соединений её окружают, зависит колоссальное разнообразие свойств природных и синтетических высокомолекулярных соединений — полимеров. Человек уже многое понял в этом мире молекул, но ещё больше осталось непознанного и тем более интересного.
Многообразие молекул было бы не возможно, если бы не было изометрии. Достаточно сказать, что число структурных изомеров только углеводорода С25Н52 достигает 36 797 588. Легко представить, во сколько раз увеличивается число изомеров для любого производного такого углеводорода, а ведь именно подобные соединения и составляют живые ткани организмов. Первостепенную роль в живой природе играет и оптическая изометрия. Белки образованы аминокислотами лишь одной оптической конфигурации. Такое требование становится понятным, если вспомнить вторичную структуру молекулы белка. Включение в цепь аминокислот другой оптической конфигурации внесло бы нерегулярность в структуру белковой молекулы, нарушило бы её третичную структуру. Отсюда вытекает важное следствие: в пищу человек может применять лишь один из антиподов каждой аминокислоты, другой антипод питательным веществом не является.
Почти все биологически активные вещества — гормоны, многие лекарства, витамины — содержат в молекуле асимметрический атом углерода и поэтому являются оптически активными. Организмы животных и растений обычно вырабатывают только один из двух возможных антиподов. Я говорила, что в большинстве случаев химические свойства антиподов не различны. Это не относится к ферментам, которые весьма разборчивы и могут воздействовать лишь на один строго определенный оптический изомер. Интересно, что оптические антиподы часто можно различить самым простым способом — на вкус ил по запаху. Не исключено, что применение стереохимической теории изомерии поможет в будущем решить проблему рецепции запаха и вкуса.
Использованная литература
1. Буцкус П. Ф. Книга для чтения по органической химии. Пособие для учащихся. М., «Просвещение», 1975. — 271с. с ил.
2. Павлов Б.А., Терентьев А.П. Курс органической химии. М., «Химия», 1965 — 686с.
3. Парменов К.Я., Сморгенский Л. М., Цветков Л.А. Книга для чтения по химии. Часть 2. Государственное учебно-педагогическое издательство министерства просвещения РСФСР, М., 1961 — 632с. с ил.
4. Химия в школе. Научно-методический журнал Министерства просвещения СССР. №3. 1982г.
Рецензия на реферат по химии
ученицы 11 «А» класса средней общеобразовательной школы 20
Даниловой Дарьи
на тему «Явления изомерии в органической и неорганической химии. Зависимость свойств веществ от их строения»
За теоретическую основу работы автор взял теорию А.М.Бутлерова с учетом ее последующего развития в направлении пространственных представлений о строении молекул. Основываясь на современных представлениях о строении вещества, автор дал обоснование некоторым причинам реакционной способности веществ, а также смог полнее раскрыть предпосылки многообразия органических соединений.
Данная рефератная работа ориентирована на развитие теоретических идей в процессе изучения органической химии, на более тесное сочетание теорий и фактов при объяснении и предсказании явлений химии. Процесс развития самого научного знания раскрыт автором в историческом плане. В органической химии такой подход наиболее уместен именно на примере теории строения. Автор в работе знакомит с возникновением теории строения, этапами ее дальнейшего развития, ее движущими силами.
Достоинством данной рефератной работы является применение обширной опорной информационной базы о различных органических веществах, использованной для освещения достаточно сложного теоретического материала.
В своей работе автор дал характеристику основным типам изомерии, причем для иллюстрации были использованы сведения как из области, традиционной для исследования данного явления – области органической химии, так и сведения об изомерных отношениях в неорганической химии.
В данном реферате был проанализирован и обобщен один из наиболее сложных аспектов изучения химии в средней школе, но, не смотря на это, стиль данной работы является вполне доступным для восприятия.
Учитель химии: Туманова Г.А.
[1] CO(NH2)2 — диамид угольной кислоты (мочевина) был обнаружен в моче, впервые синтезирован в1828 году Велером по принципу перегруппировки цианата аммония при t:
NH4OCN→CO(NH2)2. Первый синтез органического соединения из неорганического.
[2] От греческого слова «изомерес», что означает «состоящий из равных частей».
|
из
5.00
|
Обсуждение в статье: Изомерия в органической химии |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

