 |
Главная |
ГЛАВА 4. СТРУКТУРА И ФАЗОВЫЙ СОСТАВ ДНА
|
из
5.00
|
Степень совершенства кристаллической структуры алмаза детонационного синтеза зависит от условий взрывного синтеза. Так, электронограмма алмаза, полученного из активированного угля при ударном обжатии 80 МПа за 10-12 с, характеризуется набором трёх отражений (111), (220) и (311) кубического политипа. Размер области когерентного рассеяния этих алмазов оценен по уширению линий примерно в 10 нм [61, 62].
В условиях ударного обжатия графита в смеси с металлом образуется кубический и 2Н гексагональный политип алмаза [63] в соотношении (для алмазов торговой марки Mypolex) 78 объёмн.% кубического политипа и 22 объёмн.% гексагонального [64]. По данным Товстогана, доля лонсдейлита во взрывных алмазах, полученных ударным обжатием чугуна, может доходить до 50% [65].
Алмазы, полученные при детонации смесей углерода с взрывчатыми веществами. При детонации смесей графита с циклотриметилентринитрамином образуются алмаз кубической и гексагональной модификации в смеси с исходным графитом в количестве до
25...30 масс.% [66], а Ямада и Савоока обнаружили также n-алмаз и
i-углерод [67] в виде частиц округлой формы.
Фазовый состав алмазов, полученных из углерода взрывчатых веществ (ДНА). Процесс образования ДНА протекает за время порядка 10-6 с, затем температура и давление снижаются с 3000...4000 K и c 20...30 ГПа до нормальных значений (градиент падения давления и температуры определяется условиями подрыва). Естественно, что вследствие высокой неравновесности этого процесса в конечных продуктах содержится несколько фаз углерода. Эти наноалмазы, вероятнее всего, должны иметь алмазное ядро с оболочкой из неалмазного углерода. Это связано с процессом графитизации алмазов в волне разгрузки, когда давление резко падает, а температура образца остается высокой [68, 69].
В продуктах детонации циклотриметилентринитрамина в ледяной оболочке наряду с кубическим политипом алмаза авторы обнаружили еще одну фазу алмаза [70]. (Возможно, этой фазой мог быть i-углерод, так как в продуктах детонации содержится достаточно большая концентрация азота, или карбин, обнаруженный позднее в продуктах детонации зарядов ВВ тринитротолуол-циклотриметилентринитрамин массой 150 кг [71].) При детонации смеси углерода с циклотриметилентринитрамином на рентгенограмме заметен широкий максимум аморфной фазы [66], на который авторы не обратили внимания.
Впоследствии [72, 73] было установлено, что в продуктах детонации тринитротолуола с циклотриметилентринитрамином содержание аморфной фазы может доходить до 80% (рентгенографически она определяется по интенсивности отражения с межплоскостным расстоянием d = 0,418 нм). Искаженные алмазные структуры – i-углерод и
n-алмаз - не обнаружены.
Таким образом, существенным отличием алмазов, полученных из углерода взрывчатых веществ, является наличие одной кристаллической фазы алмаза (кубический политип) и аморфной алмазной фазы. Можно предположить, что её количество определяется условиями проведения процесса детонации: в процессе ударного обжатия, где используют ВВ с низкой скоростью детонации (5200 м/с), аморфная фаза отсутствует, а в более высокоскоростных процессах – обнаружена. Это можно объяснить тем, что аморфная фаза является промежуточным состоянием при образовании кристаллической фазы ультрадисперсного алмаза.
Определение содержания неалмазных форм углерода возможно несколькими методами, которые базируются на различии фаз по реакционной способности и кристаллическому строению.
Возможно определение НФУ (аморфного, графитного и карбидного) окислением их смесью концентрированной серной кислоты с CrO3 в токе кислорода с определением выделившегося диоксида углерода кулонометрическим титрованием [74]. Для анализа продуктов статического синтеза алмазов предложено послойное электрохимическое растворение цилиндрического образца с его последующим анализом [75]. При изучении окисления детонационных наноалмазов в атмосфере воздуха методом ДТГ при скорости нагревания не более чем
1,25 K/мин было обнаружено разделение экзотермического эффекта окисления алмазной фазы на два (рисунок 1).
На основании этого было высказано предположение, что первая из этих стадий относится к процессу окисления более реакционноспособной аморфной фазы алмаза. Это позволяет количественно определять аморфную и кристаллическую фазы алмаза [76, 77]. Используя этот метод, установили, что в детонационном углероде содержится НФУ 40...45 масс.%, рентгеноаморфной фазы алмаза 15...20% и кристаллической фазы алмаза 30...35%. В то время как в образцах ДНА, полученного очисткой смесью серной и азотной кислот, содержание аморфной фазы алмаза колеблется от 3 до 7%, остальное - кристаллический алмаз. Из приведенных авторами данных следует также, что в процессе очистки удаляется примерно 2/3 аморфной алмазной фазы.

Рисунок 1 – Кривые дифференциально-термической гравиаметрии (ДТГ) окисления на воздухе ДУ (1) и ДНА (2) при скорости нагревания 1,25 град/мин.
В работе Чен Квана [78] представлена рентгенограмма ДНА, полученного при детонации в водной оболочке (нижняя кривая рисун-
ка 2). Из этой рентгенограммы видно, что у данного образца ДНА отсутствует аморфная фаза (широкий пик в области 20...30° углов 2Q).

Рисунок 2 – Участки рентгенограмм образцов ДНА [78]
Возможно, отсутствие аморфной фазы можно связать с её более высокой реакционной способностью, вследствие которой аморфная фаза алмаза газифицировалась, прореагировав с водой:
Сам.фаза + H2O = CO + H2.
Таким образом, наличие аморфной фазы углерода, присутствующей в алмазах детонационного синтеза, выделяет эти алмазы среди других синтетических алмазов.
Параметр кристаллической решётки алмаза. Природные и синтетические алмазы. В 1960 году по данным нескольких лабораторий было принято прецизионное значение параметра решётки кубического политипа алмаза а = 0,356703 ± 0,0000010 нм [79]. Спустя 15 лет было предложено уточненное значение 0,3566986 ±0,0000002 нм [80].
Ультрадисперсные алмазы. Согласно данным [72] параметр кристаллической решётки ДНА, рассчитанный по центру тяжести отражения (220) на кобальтовом фильтрованном излучении по линии а1, равен 0,3562±0,0003 нм. Параметр кристаллической решётки алмазов марки АСМ, определенный этим же методом, дал значение 0,3566±0,0003 нм. Расчёт параметра кристаллической решётки ДНА по отражениям от плоскостей (331) и (420) с использованием СuКa1 излучения и графитового монохроматора дал значение 0,3573±0,0001 нм [81]. Принимая во внимание большую размытость этих дифракционных пиков высоких порядков отражения и высокодеформированное состояние ДНА, можно полагать, что более вероятно сжатие кристаллической решётки ДНА, чем сохранение параметра кристаллической решётки неизменным. Это, прежде всего, связано с тем, что происходит обжатие капель жидкого алмаза при их резком захолаживании.
Следует отметить также, что для частиц металлов размером 10 нм параметр кубической решётки уменьшается на 5.10-2% от первоначального значения [82]. В случае ДНА с размером частиц 4 нм это изменение больше и составляет 1,4∙10-3, что, по-видимому, можно связать не только с меньшим размером частиц ДНА, но и с условиями образования – высоким давлением (минимальное значение – 15 МПа). Это сжатие кристаллической решётки является результатом действия лапласовского давления, испытываемого со стороны поверхности частицами малого размера. Изменение среднего межатомного расстояния можно оценить из относительного изменения объёма:

где r – радиус частицы;
k – коэффициент объёмной сжимаемости;
s – поверхностная энергия.
Величина 2s/r – это лапласовское давление. При размере частиц 10-8 м, s » 1 Дж/м2, k » 10 м3/Дж изменение объёма составляет 10-2, что соответствует относительному изменению межатомного расстояния 3.10-3 [83]. Эта оценка подтверждается представленными ниже данными.
В отношении ультрадисперсных частиц нитрида бора, изоэлектронного алмазу, известно, что они характеризуются значительными искажениями кристаллической решётки и микронапряжениями. Так, при анализе структурных искажений в ультрадисперсном нитриде бора со средним размером частиц 5,3 мкм установлено, что базисные плоскости в нём существенно деформированы под влиянием сил поверхностного давления. Для наиболее деформированных участков частиц нитрида бора сокращение параметра решётки может достигать 4.10-3нм, что соответствует эффективному давлению более 20 ГПа, а укорочение связи B-N в слое составляет 3.10-3нм [84].
Для ультрадисперсных частиц алюминия и золота также наблюдается сжатие кристаллической решётки, вызванное некомпенсирован-ностью связей атомов поверхностных слоев [85].
Рентгеновская плотность алмазов. Экспериментально определенная рентгеновская плотность природных алмазов составляет
3,5140 Мг/м3…3,5152 Мг/м3 [86] (теоретическое значение –
3,5150 Мг/м3).
Создание искусственной дефектности за счет облучения природных алмазов медленными нейтронами несколько снижает их плотность благодаря смещению атомов углерода из узлов кристаллической решётки – с 3,5140 до 3,5130 Мг/м3. Отжиг при 823...873 K восстанавливает первоначальную величину плотности [86].
Проведённый автором расчёт рентгеновской плотности дал следующие результаты: для ДНА (параметр решётки 0,3562 нм) плотность составляет 3,527 Мг/м3; для алмазов ДАС (0,3572 нм) – 3,498 Мг/м3 (очевидно, для идеальных участков кристаллов). Исследование пикнометрической плотности алмазных порошков показало [87], что для алмазов статического синтеза она находится в пределах 3,50...3,60 Мг/м3 и связана с включениями металла-катализатора в процессе синтеза.
Пикнометрическая плотность образцов ДНА ниже рентгеновской, и её максимальное значение составляет 3,21 Мг/м3 (обычно около
3,05 Мг/м3 [88]), а плотность детонационных алмазов –
3,15...3,25 Мг/м3 [89]. (Влияние температуры прокаливания и состава газовой атмосферы на пикнометрическую плотность ДНА представлено ниже в главе 6.)
Следует отметить, что расчётное значение плотности ДНА (3,527 Мг/м3) стоит относить не ко всем частицам, а к той части кластера, которая лишена поверхностных групп, снижающих плотность образца в целом.
Таким образом, ДНА характеризуются сжатой кристаллической решёткой по сравнению с другими синтетическими алмазами, а пикнометрическая плотность ДНА ниже рентгеновской.
Искажения кристаллической решётки детонационных наноалмазов. Несовершенство кристаллической решётки детонационных алмазов выражается отсутствием отражений высоких порядков на рентгенограммах. Так, на рентгенограмме алмазов, полученных при детонации смеси тринитротолуола с циклотриметилентринитрамином, всего 5 отражений. Их относительная интенсивность характеризуется следующим распределением: (111) – 85,0%{44}, (220) – 14,0%{22}, (113) – 0,5%{18}, (400) – 0,3%{4}, (331) – 0,2%{12} (в фигурных скобках приведены значения доли для пяти отражений природного алмаза по ASTM Index 6 675) [72]. Можно предположить, что преобладание в спектре отражения от плоскости (111) по сравнению с эталоном связано с формой частиц (подробнее об этом в главе 8).
Из примесей, входящих в состав ДНА, особо следует выделить азот, так как он может внедряться в кристаллическую решётку алмаза и деформировать её, а водород и кислород должны находиться преимущественно на поверхности алмазной фазы в составе функциональных поверхностных групп.
В работе [90] высказано предположение, что атом азота, замещающий атом углерода в кристаллической решётке алмаза, имеет три ближайших соседних атома углерода на расстоянии 0,147 нм. Оставшиеся два его электрона образуют неподеленную пару, четвертый атом углерода находится от внедренного атома азота на расстоянии около 0,25 нм и имеет неспаренный электрон. Таким образом, создаются условия для расширения элементарной ячейки алмаза.
Установлено, что при повышении концентрации парамагнитной примеси азота х происходит увеличение постоянной кристаллической решётки природного алмаза в соответствии с уравнением:
а0 = (0,356768 + 6,4∙10-5lgx) нм, где 0,001< x < 0,114 ат.% [90].
В другой работе для природных алмазов эта зависимость задается прямой с наклоном Da/Dc = 3,9∙10-40м4 [91], а для А-центров в алмазе – 0,9∙10-40м4 [35].
Концентрация атомов азота в ДНА аномально высока по отношению к другим типам алмазов и доходит до 3,1×1021 ат/см3. Если распространить и на ДНА зависимость между увеличением параметра
кристаллической решётки и концентрацией азота, то можно было бы ожидать увеличения параметра кристаллической решётки на 0,0012 нм или на 3,3×10-3 от нормального значения. Экспериментально же было обнаружено сжатие кристаллической решётки ДНА на 1,4×10-3. Таким образом, можно прийти к выводу, что не все атомы азота входят в кристаллическую решётку.
Микроструктура ДНА. Определение параметров микроструктуры ДНА было проведено из анализа формы профиля линий (220) методом четвертых моментов [92]. Были рассчитаны размер областей когерентного рассеяния и величина микронапряжений второго рода. Величина микронапряжений второго рода определялась по формуле:
s = E∙(Da/a),
где Е = 1000 ГПа – модуль Юнга алмаза [93].
Параметры микроструктуры ДНА приведены в таблице 1, где они сравниваются с данными для взрывных алмазов, полученными в других вариантах детонационного синтеза.
Таблица 1– Микроструктура образцов детонационных алмазов
| ОКР, нм | Микронапряжения второго рода | Параметр кристаллической решётки, нм | Исходный состав взрывчатого | |
| Dа/а, % | ГПа | |||
| 4-6 | 1 | 10 | 0,3562±0,0003 | Тринитротолуол –циклотриметилентринитрамин |
| 5-10 | 0,42-0,47 | 4,2-4,7 | - | Вода - циклотриметилентринитрамин |
| 5-15 | 0,1 | 1,0 | 0,3572±0,0004 | Углерод - циклотриметилентринитрамин |
Как следует из данных таблицы 1, образец ДНА, полученный из сплава тринитротолуола с циклотриметилентринитрамином, характеризуется наибольшими значениями микронапряжений второго рода и, как следствие этого, наиболее деформированной решёткой. Такие же данные были получены позже и Чен Кваном [94].
Впоследствии [95], используя методы рентгеноструктурного анализа на обычном излучении, были сопоставлены структурные характеристики алмазов детонационного и взрывного синтеза. Полученные данные показали, что ДНА имеют меньший размер зерна и что их
кристаллическая кубическая решётка более напряжена и расширена по сравнению с кристаллической решёткой взрывных алмазов.
Из анализа профиля линии (220) образцов ДНА было установлено, что смещение атомов углерода в кристаллической решётке составляет 0,006...0,021 нм, объёмная доля аморфной фазы алмаза составляет от 46 до 80 объёмн.%. Среднеквадратичные статические смещения, как и рентгенографическая плотность, определяются дефектностью кристаллической решётки. Поэтому между ними существует обратная зависимость. С увеличением статических среднеквадратичных смещений и уменьшением рентгенографической плотности качество кристаллической решётки алмаза ухудшается.
Энергонасыщенность детонационных наноалмазов. Наличие большого количества поверхностных атомов с некомпенсированными связями является причиной наличия избыточной поверхностной энергии ультрадисперсных частиц и ДНА в частности.
Исследования, проведенные для металлов с дефектами упаковки [96], показали, что энергия поверхности раздела кристалл - пар вносит наиболее существенный вклад в энергетику поверхности по сравнению с вкладами от энергии дефектов упаковки, энергии границы двойников и энергии границ зёрен.
Свободная поверхностная энергия порошков разных видов синтетических алмазов была оценена на основании адсорбционных измерений [97]. Она изменяется в пределах от 1 до 6,5 Дж/м2 в зависимости от типа алмаза.
Поверхностная энергия детонационных наноалмазов была оценена по данным рентгенофазового анализа.
В описываемом случае ввиду малого размера частиц ДНА представлялось целесообразным рассчитать поверхностную энергию, принимая во внимание энергетический вклад отдельных кристаллографических плоскостей алмазов по данным [98] и по экспериментально определенному значению площади удельной поверхности ДНА. Было сделано допущение, что доля отражений данной кристаллографической плоскости в объёме и поверхности ДНА одна и та же. Расчётное значение поверхностной энергии определялось по формуле:
Us= S hkl∙shkl∙Shkl ,
где shkl – удельная поверхностная энергия кристаллографической плоскости hkl, Дж/м2;
Shkl – площадь поверхности плоскости hkl для образца единичной массы.
Теоретическое значение величины поверхностной энергии, рассчитанное из этого уравнения, составляет 3273 кДж/кг.
Экспериментальная величина избыточной энергии, вычисленная из теплоты сгорания образцов ДНА по отношению к энтальпии
образования диоксида углерода, составляет 2563...2952 кДж/кг (в зависимости от условий термообработки ДНА) [99].
Таким образом, наблюдается удовлетворительное совпадение расчётной и экспериментальной величин поверхностной энергии ДНА. Более низкое значение экспериментальной величин поверхностной энергии следует, по-видимому, связать с наличием дополнительной внутренней поверхности ДНА, которая не принималась во внимание при расчёте (подробнее об этом изложено в главе 8).
Если допустить, что по форме частицы ДНА представляют собой полые сфероиды с внешним и внутренним диаметром 4 и 2 нм соответственно (см. главу 8), то доля внутренней поверхности будет составлять pr2/pR2 = 0,25 от площади внешней поверхности. В таком случае суммарная поверхность для ДНА составит 1,25×300 = 375 м2/г. Если воспользоваться данными [97], то максимальное значение поверхностной энергии составит 375 м2/г ∙ 6,5 Дж/м2 ∙1000 г = 2437 кДж/кг. Эти расчётные данные незначительно отличаются от экспериментальных.
На основании этих данных можно оценить (предположив, что доля кристаллической составляющей – 100%), что предельное значение энтальпии образования ДНА с удельной поверхностью 300 м2/г имеет величину 41,173 кДж/моль (для кристаллического алмаза –
1,897 кДж/моль).
Требует более тщательного изучения вопрос о дефектности частиц ДНА. Вследствие их малого размера можно предположить (принимая во внимание минимальный размер дислокационной петли 0,5...1,5 мкм [100]), что у частиц ДНА отсутствует дислокационная структура, как и у ряда других ультрадисперсных частиц [101]. В пользу этого предположения свидетельствует факт отсутствия отжига дефектов у ДНА, что может быть связано с малыми размерами частиц.
Метастабильность ДНА. По данным дифференциальной сканирующей калориметрии при атмосферном и повышенном (40 кПа) давлении нагревание ДНА до температуры 873 K в атмосфере инертного газа не сопровождается процессами выделения энергии [68]. Позднее было установлено, что при использовании давления 10 ГПа наблюдаются очень быстрые фазовые переходы (менее 1 мкс) у таких наночастиц, как ДНА, фуллерен С60 и нитрид бора B24N36 [102]. Авторы связывают это с большой величиной поверхностного натяжения этих частиц. При давлении 10 ГПа выделение энергии равно 4186, 5065 и
5211 Дж/г, в результате чего образуются графит, алмаз и гексагональный нитрид бора соответственно. (Такое высокое значение выделения энергии связано с суммированием двух эффектов – энергии фазового перехода и энергии перехода из ультрадисперсного состояния в кристаллическое.)
Исследование детонационных наноалмазов, полученных при детонации ВВ в жидких средах, показало, что ДНА, в отличие от данных всех ранее известных работ, нестабилен [103]: после нескольких месяцев хранения наблюдается существенное изменение структуры, происходит укрупнение алмазных конгломератов и уменьшение доли алмазной фазы, формирование монокристаллов карбина из цепочек и формирование аморфных углеродных частиц. Авторы полагают, что ДНА с размером частиц 10 нм являются менее стабильными, чем карбин и фуллерены, и превращаются в них по мере старения. Данные о термодинамической неустойчивости детонационных наноалмазов, полученных подрывом в газовых средах, неизвестны. И даже более того, имеется сообщение о том, что ультрадисперсные алмазы размером частиц 3 нм космического происхождения более устойчивы, чем графит [104].
В работе Анисичкина В.Ф. и Титова В.М. [105] было высказано предположение, что частицы алмаза, имеющие размеры больше критического при данной температуре и граничащие с графитом, будут со временем распадаться на алмаз и графит, а меньшие частицы алмаза – расти за счёт контактирующего графита. Авторы предположили, что критический диаметр ДНА равен 2,5 нм. Также был предложен ряд теоретических моделей для описания стабильности нанофаз углерода [106-112]. Все эти модели предсказывали, что частицы алмаза диаметром 5…6 нм более стабильны, чем графит. Позже, в работе Барнарда с коллегами [113] при сопоставлении термодинамической стабильности нанофаз графита, алмаза и фуллуренов было уточнено, что наноалмазы термодинамически более устойчивы, если содержат от 1127 до 24398 атомов углерода. Это соответствует кубическому кристаллу диаметром примерно от 1,9 до 5,2 нм.
Неадекватность представленных выше данных может быть объяснена тем, что диаграмма состояния углерода для его высокодисперсного состояния имеет другой вид, чем для монокристаллов, так как диаграммы состояния для ультрадисперсных систем являются пространственными (третьей координатой является размер частиц). Поэтому для понимания процесса образования ДНА было бы полезным построение такой диаграммы.
Фазовая диаграмма ультрадисперсного углерода. Диаграмма состояния углерода – это предмет постоянного уточнения границ фаз в области сверхвысоких давлений и температур. В последний вариант [114] (рисунок 3) внесено уточнение, касающееся границы фаз между жидким углеродом и алмазом. В соответствии с ним плотность жидкого углерода в области, граничащей с кристаллическим алмазом, имеет меньшую плотность.

Рисунок 3 – Последняя версия фазовой диаграммы углерода [114]
Линии представляют собой границы фазовых равновесий. A – область статического каталитического синтеза алмазов из графита;
B – область детонационного синтеза алмаза из графита; C – область существования графита; D – область перехода гексагонального графита в гексагональный алмаз статическим методом синтеза; E – область ударного превращения графита в гексагональный алмаз; F – ударное превращение графита в кубический алмаз; пунктирная линия
B, F, G – линия перехода графита или гексагонального алмаза в алмаз кубической сингонии; линия H, I, J – спрессованный графит обладает свойствами алмаза, но превращается в графит после снятия нагрузки.
В последнее время в связи с разработкой методов получения алмазов в ультрадисперсном состоянии высказаны замечания о неприменимости данной диаграммы состояния для рассмотрения процесса синтеза детонационных наноалмазов [79, 115]. В работе Морохова [116] отмечалось, что диаграмма состояния однокомпонентной ультрадисперсной системы будет отличаться от диаграммы состояния массивного вещества положением линий фазовых равновесий при переходе из дисперсного в жидкое или из аморфного в кристаллическое состояние. Оценку линий фазовых равновесий можно провести в приближении, учитывающем изменение энтропии ультрадисперсной системы и избыточной поверхностной энергии [117].
Известны два противоположных подхода при построении фазовых диаграмм. Первый заключается в измерении термодинамических характеристик и дальнейшем расчёте по термодинамическим законам и закладываемой модели. Второй заключается в экспериментальном построении фазовой диаграммы методами физико-химического анализа.
Построение фазовой диаграммы ультрадисперсного углерода на основании термодинамических расчётов представлено в работах Викторова, Губина и Маклашовой [118, 119]. В этих исследованиях сообщается о смещении линий фазовых равновесий и уменьшении температуры плавления углерода с ростом его дисперсности.
Ниже приводится диаграмма состояния углерода, построенная из пока немногочисленных экспериментальных данных.
В связи с изложенным выше диаграмма состояния ультрадисперсного углерода будет построена следующим образом. В горизонтальной плоскости будет располагаться диаграмма состояния углерода в массивном состоянии [114], а по вертикальной оси будет отложена дисперсность системы. В горизонтальной плоскости примем дисперсность 100 нм (при таком размере частиц вкладом поверхностных состояний в свойства вещества можно пренебречь). Минимальный размер частиц алмаза, полученных в процессе детонации, составляет
1,8 нм [120-122]. Поэтому в вертикальной плоскости область существования алмазной фазы будет изменяться до 1,8 нм. Положение тройной точки углерода с дисперсностью изменится. Для построения этой плоскости воспользуемся данными работ [2, 123], где указано, что при температуре 3000 K происходит образование частиц алмазов со средним размером 4 нм. Таким образом, можно допустить, что положение тройной точки углерода при переходе к частицам размером 4 нм сместится с 5000 K до 3000 K.
Что касается положения границы твёрдых фаз углерода и алмаза, то она также изменится. Имеются сообщения, что при размерах частиц 2,5…3,0 нм алмаз более термодинамически устойчив, чем графит [104, 105]. (К такому же выводу пришли Винтер и Ри [124], указавшие, что алмазные кластеры, состоящие из 30 000…70 000 атомов, менее стабильны, чем графитные кластеры такого же размера.) Поэтому в верхней части диаграммы состояния в области меньше 3 нм будет присутствовать только фаза алмаза.
Принимая во внимание перечисленные выше данные, диаграмма состояния ультрадисперсного углерода будет выглядеть следующим образом (рисунок 4).
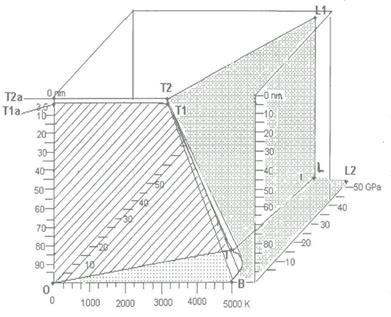
Рисунок 4 – Фазовая диаграмма ультрадисперсного углерода
Из построенной пространственной диаграммы следует, что часть пространства, ограниченная точками ОТ1аТ1В – это область устойчивости графита, а оставшаяся часть – это область существования алмаза.
Расчёты, проведённые группой исследователей из Ливерморской национальной лаборатории [125], дали основание предположить, что углеродные частицы, содержащие примерно от 103 до 104 атомов углерода, могут находиться в жидком состоянии при более низкой температуре, чем углерод в обычном состоянии.
Здесь следует дополнить, что в связи с обнаружением новой тетрагональной фазы для ДНА [126] на диаграмме должна появиться граница раздела между алмазом кубической модификации и тетрагональной, которая должна находиться на плоскости ОТТ1Т1а.
Поскольку исследования в области ультрадисперсного углерода еще не так обширны по сравнению с углеродом в обычном состоянии, то многие детали на этой диаграмме состояния, несомненно, будут уточнены в будущем.
Оценка поверхностного натяжения и растворимости газообразных водорода и азота в жидком алмазе. Исследование свойств углерода и алмаза в области их плавления представляет собой технически очень сложную задачу, требующую уникального оборудования [127]. Поэтому многие данные были получены только расчётными методами [128].
Единственной возможностью изучения закристаллизовавшихся жидких алмазов в настоящее время является исследование детонационных наноалмазов, сформировавшихся из углерода взрывчатых молекул [117]. При этом образуются округлые частицы размером от 2 до
6 нм [1, 123]. Алмаз в жидком состоянии характеризуется плотностью 3,2198 Мг/м3 [128], в то время как плотность кристаллической фазы алмаза 3,515 Мг/м3. Вследствие этого при быстропротекающих процессах охлаждения кристаллизация капель алмаза с поверхности приводит к образованию полостей внутри алмаза. Плотность детонационных наноалмазов вследствие этого ниже плотности кристаллического алмаза и изменяется в диапазоне 3,00...3,21 Мг/м3 [129]. Эта величина связана с газовыми включениями азота и водорода, которые были растворены в жидком алмазе в процессе формирования жидких капель. Плотность алмазной оболочки совпадает с плотностью природного алмаза.
Размер частиц ДНА, определенный методами электронной просвечивающей микроскопии высокого разрешения и малоуглового рентгеновского рассеяния, составлял 2...6 нм. Получение ДНА при более высокой температуре за счет детонации бензотрифуроксана позволило получить частицы средним размером 31 нм [128]. Таким образом, при температуре 3000 K и давлении 30 МПа капли жидкого алмаза имеют средний размер 4 нм, а при температуре 4000 K и давлении ~40 МПа –
31 нм.
Формально для оценки поверхностного натяжения в данном случае можно воспользоваться только уравнениями метода взвешивания капель (закон Тейта) W = 2prs и W = 4/3pr3rg. Уравняв их между собой, получим s = 2/3(r2rg).
Подставив соответствующие значения, для частиц диаметром
4 нм и плотностью 3,05 Мг/м3 (наиболее характерное значение плотности для ДНА) получим величину поверхностного натяжения
s = 7,98×10-14 Дж/м2, а для частиц размером 31 нм с такой же
плотностью – s = 2,87×10-11 Дж/м2. (Величина поверхностного натяжения для кристаллической грани алмаза (111) составляет 11,4 Дж/м2, а поверхностное натяжение для жидкого гелия при 3 K составляет всего 2,2∙10-4 Дж/м2.) Таким образом, классический подход не применим для оценки поверхностного натяжения ультрадисперсных частиц.
Из термодинамической теории Толмэна [131] следует, что поверхностное натяжение зависит от дисперсности. Теория, учитывающая это влияние, дает следующее соотношение:
s/sд = 1 + 2lo/r,
где sд – поверхностное натяжение при кривизне поверхности тела 1/r ;
s – поверхностное натяжение при плоской поверхности тела;
lo – толщина поверхностного слоя.
Отсюда sд = s/(1 + 2lo/r,), или 5,7 Дж/м2, для кристаллической грани (111), преобладающей в кристаллической решётке детонационных наноалмазов. Взяв эту величину за базовую и применив уравнение Гиббса - Кюри - Вульфа, можно было бы рассчитать поверхностное натяжение и для других кристаллографических плоскостей алмаза в ультрадисперсном состоянии.
Таким образом, при переходе к ультрадисперсным частицам величина поверхностного натяжения алмаза уменьшилась более чем в два раза. Обычно при фазовом переходе из твёрдого в жидкое состояние величина поверхностного натяжения уменьшается не так значительно – для металлической меди на 11%, а для металлического серебра на 19%.
Так как жидкий алмаз, полученный при детонации взрывчатых веществ, представляет, вероятнее всего, раствор, содержащий водород и азот [132], то можно оценить и растворимость этих газов в жидком алмазе в условиях формирования жидкой фазы.
В расчётах будем исходить из данных по качественному и количественному составу газов, выделяющихся при механическом разрушении ДНА [133], и плотности жидкого алмаза с растворенными газами 3,2198 Мг/м3 [128].
При механическом разрушении объём выделившихся газов составил 8,6 см3/г, и они состояли из азота и водорода – по 46,4 объёмн.% (остальное – 6,3% метан и 19% диоксид углерода). Если предположить, что метан образовался в результате взаимодействия между
водородом и углеродом, то в таком случае объёмная доля водорода составит после нормализации 44,6%, а азота – 39,3 объёмн.%.
Проведенные соответствующие расчёты дали следующие результаты: растворимость водорода в жидком алмазе составляет
3,84 см3/г, а азота 3,38 см3/г, что эквивалентно 12387,0 см3/л и
10903,2 см3/л соответственно (или же условно 0,55 М и 0,48 М
растворам соответственно). То есть растворимость водорода превышает растворимость азота в 1,14 раза (растворимость водорода в бензоле превышает растворимость азота в 1,53 раза).
Таким образом, получены качественно удовлетворительные результаты по относительной растворимости газов в жидком алмазе. Количественная оценка требует проведения дополнительных исследований, прежде всего определения объёмов выделившихся газов, а не десорбированных с поверхности после разрушения алмазных частиц.
|
из
5.00
|
Обсуждение в статье: ГЛАВА 4. СТРУКТУРА И ФАЗОВЫЙ СОСТАВ ДНА |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

