 |
Главная |
Реакции двойных связей
|
из
5.00
|
Большинство терпеноидов являются ненасыщенными соединениями и претерпевают превращения, обусловленные наличием двойных углерод-углеродных связей. Трех- и четырехзвенные циклы бициклических структур, имеющие тенденцию к раскрытию из-за напряжений внутри малого цикла, также вступают в реакции, характерные для алкенов.
Реакции присоединения
Реакции присоединения – наиболее типичные реакции алкенов. По двойной связи могут присоединяться водород, галогены, галогеноводороды, вода, кислоты и другие реагенты. Многие из подобных реакций имеют большое значение в химии терпеноидов и широко используются в практических целях.
3.2.1.1 Присоединение водорода. Присоединение водорода (гидрирование) переводит ненасыщенные соединения в насыщенные. Присоединение связано с разрывом π-связи и образованием вместо нее двух более прочных σ-связей. В результате выделяется энергия, т.е. гидрирование является экзотермической реакцией, ∆Н ≈-125 кДж/мол.
В отсутствие катализатора гидрирование протекает крайне медленно даже при сильном нагревании. Это означает, что реакция характеризуется высокой энергией активации ∆Еа. Катализатор эффективно снижает величину ∆Еа, сорбируя реагенты на активных центрах своей развитой поверхности с ослаблением или разрушением π-связей. Присоединение водорода и десорбция насыщенной молекулы завершают процесс. Наиболее активными катализаторами являются металлы платиновой группы. Для практических целей чаще используют более доступные никелевые катализаторы.
Гидрирование – обратимый процесс. Катализаторы одновременно ускоряют и обратную реакцию – дегидрирование (как известно, катализатор не оказывает влияния на равновесие реакции). Для сдвига равновесия в сторону продуктов гидрирования процесс проводят при высоком давлении.
Реакция гидрирования чувствительна к пространственным затруднениям. Легче всего насыщаются концевые двойные связи. Двойные связи в середине цепи, особенно при наличии объемных заместителей, насыщаются трудно. Поэтому у лимонена, например, легко добиться высокой селективности насыщения только одной двойной связи:

лимонен п-ментен
Сопряженные двойные связи гидрируются ступенчато:
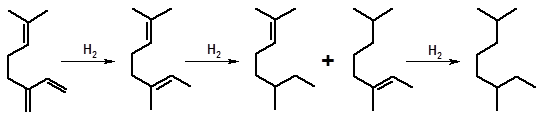
мирцен линалоолен
Напряженные трех- и четырехзвенные циклы бициклических терпеноидов также могут присоединять водород. Однако гидрирование по циклу идет труднее, чем по двойной связи, поэтому в первую очередь насыщается двойная связь, а затем раскрывается напряженный цикл:

3-карен каран п-ментан м-ментан
Многие реакции гидрирования используются в промышленных процессах. Превращение α-пинена в пинан является первой стадией синтеза гераниола, линалоола и других душистых веществ терпеноидной структуры из этого доступного углеводорода.
Гидрированием изопулегола, пиперитола, пиперитона получают ментол.
Превращение цитраля в цитронеллаль является первой стадией синтеза одного из наиболее ценных душистых веществ – гидроксидигидроцитронеллаля (гидроксицитронеллаля, ГОЦ):

цитраль цитронеллаль ГОЦ
3.2.1.2 Необратимый катализ Зелинского. Интересно исследованное академиком Н.Д. Зелинским поведение моно- и бициклических монотерпеновых углеводородов при нагревании с катализаторами гидрирования в инертной среде в отсутствие водорода. Подобные соединения независимо от положения двойных связей и характера циклов необратимо превращаются в смесь, состоящую из ароматических углеводородов и насыщенных производных циклогексана:

лимонен п-ментан п-цимен

α-пинен п-ментан п-цимен
Данные превращения наглядно иллюстрируют относительную термодинамическую нестабильность терпеноидов. Протекающие в присутствии катализатора процессы дегидрирования и повторного гидрирования приводят к диспропорционированию, т.е. к образованию полностью насыщенных и полностью ненасыщенных (ароматических) циклов, имеющих значительно меньший запас энергии, чем частично ненасыщенные и напряженные циклы терпеноидов. Это обусловливает полное смещение равновесия вправо и делает реакцию необратимой. Описанный процесс известен в химии как необратимый катализ Зелинского.
3.2.1.3 Присоединение кислорода. Терпеноиды с сопряженными связями способны присоединять кислород при взаимодействии с воздухом на свету. Энергия квантов видимого света достаточна, чтобы активировать сопряженную систему до бирадикала, легко присоединяющего молекулу кислорода с образованием циклической перекиси:

Этот процесс облегчается в присутствии красителей, интенсивно поглощающих видимый свет и способных передавать воспринятую энергию молекулам ненасыщенных соединений. Так, α-терпинен легко окисляется в аскаридол при добавлении небольшого количества метиленового голубого:
 |
hν, краситель
α-терпинен аскаридол
Считают, что подобным образом аскаридол образуется в хеноподиевом эфирном масле. Роль облегчающего процесс красителя выполняет хлорофилл.
Полученные перекиси нестабильны и легко расщепляются с образованием бирадикалов:

Бирадикалы инициируют полимеризацию ненасыщенных соединений. Полимеризация приводит к повышению вязкости, а в тонких пленках – к затвердеванию вещества. Подобные процессы происходят при «высыхании» лаков и красок, в составе которых присутствуют ненасыщенные соединения с сопряженными двойными связями.
3.2.1.4 Присоединение галогенов. Ненасыщенные терпеноиды, как и другие алкены, легко реагируют с хлором и бромом.
Мирцен при взаимодействии с бромом образует тетрабромид:

Присоединение двух атомов брома к сопряженной системе пассивирует остающуюся двойную связь и дальнейшее присоединение не происходит.
Аналогично реагируют моноциклические терпеноиды с сопряженными системами. Так, фелландрены и α-терпинен, структуры которых характеризуются двумя сопряженными связями, образуют только дибромиды. Лимонен, терпинолен, β-терпинен, не имеющие сопряженных связей, образуют тетрабромиды:
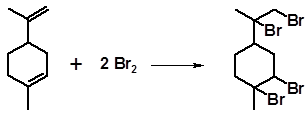
Тетрабромиды являются кристаллическими веществами и могут быть использованы для идентификации исходных соединений.
Бициклические терпеноиды в мягких условиях присоединяют бром только по двойной связи. Раскрытие напряженных циклов происходит при повышенных температурах и сопровождается перегруппировками.
Особым образом протекает хлорирование двойных связей в местах разветвления углеродной цепи. Процесс идет по механизму присоединения-отщепления:
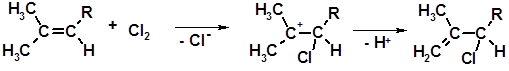
1 2
Монохлорид 2 склонен к аллильной перегруппировке:

2 3
По этому пути протекает, например, хлорирование α-пинена. При температуре до 70 оС образуется монохлорид следующей структуры:

Нагревание вызывает перегруппировку и приводит к миртенилхлориду:
 |
t  70оС
70оС
миртенилхлорид
3.2.1.5 Присоединение хлористого нитрозила. Взаимодействие терпеноидов с хлористым нитрозилом протекает по механизму реакций электрофильного присоединения (АЕ); при этом электрофилом является нитрозилкатион NО+. Присоединение протекает по правилу Марковникова:

лимонен нитрозилхлорид лимонена
Нитрозилхлориды не являются конечными продуктами реакции, если у атома углерода, связанного с азотом, имеется водород. В этом случае происходит перегруппировка, аналогичная енолизации карбонильных соединений. Перегруппировка приводит к образованию оксимхлорида, более стабильного, нежели нитрозилхлорид:

оксимхлорид
Если двойная связь находится между полностью замещенными атомами углерода, то нитрозилхлорид сохраняется. Он отличается интенсивно синей окраской. Появление этой окраски служит качественной реакцией на тетразамещенные этилены. Подобным образом реагирует, например, терпинолен:

нитрозилхлорид терпинолена
(окрашен в ярко-синий цвет)
Реакция с нитрозилхлоридом используется в промышленности для получения карвона из лимонена. Оксимхлорид подвергают дегидрогалогенированию в присутствии оснований, а образовавшийся карвоксим переводят в карвон гидролизом в кислой среде, связывая выделяющийся гидроксиламин ацетоном:

оксимхлорид оксим карвона карвон
лимонена (карвоксим)
3.2.1.6 Присоединение воды (реакция гидратации). Вода способна присоединяться по наиболее реакционноспособным двойным связям и напряженным циклам терпеноидов с образованием спиртов. Достаточная скорость реакции может быть достигнута лишь в присутствии катализаторов – кислот. Гидратация является типичной реакцией типа АЕ и протекает по правилу Марковникова.
Рассмотрим, как идет гидратация мирцена. Наличие в молекуле мирцена нескольких двойных связей приводит к образованию смеси различных спиртов. Продукт гидратации мирцена, названный Барбье (1901 г.) «мирценолом», на самом деле состоял из многих спиртов различного строения. Их образование может быть объяснено при рассмотрении механизма реакции. Гидратация легче протекает по сопряженным двойным связям. Протон связывается с одним из крайних атомов сопряженной системы:

1 2
Дальнейшее взаимодействие образовавшихся интермедиатов с водой, которая присоединяется в положение 1 или 3 сопряженных карбениевых ионов, приводит к смеси четырех спиртов:

нерол линалоол

Катионы 1 и 2, прежде чем присоединить воду, могут изомеризоваться в циклические структуры. Так, катион 1 легко образует структуру п-ментана (см. 3.1.2.1); взаимодействие с водой приводит к α-терпинеолу:
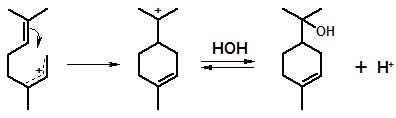
1 3 α-терпинеол
Если учесть возможность присоединения воды по изолированной двойной связи мирцена, а также изомеризационные превращения первоначально образовавшихся спиртов, можно составить представление о сложности состава продукта гидратации мирцена.
В настоящее время мирценолом называют спирт следующей структуры:

мирценол
Его получают гидратацией мирцена в присутствии кислот Льюиса и катализаторов с развитой поверхностью, например, активного угля.
Приосоединение воды к лимонену (или дипентену) приводит в обычных условиях к двутретичному гликолю терпину, поскольку реакционная способность обеих двойных связей примерно одинакова:

терпин
Терпин образуется также при гидратации 3-карена, α- и β-пиненов, где реакция идет как за счет двойной связи, так и за счет напряженного трех- или четырехзвенного цикла:
 |
3-карен
терпин
α-пинен
Терпин кристаллизуется из водных растворов с одной молекулой воды, образуя терпингидрат. Терпингидрат применяют в медицине как мягкое средство от кашля.
Частичной дегидратацией терпина можно получить одноатомные спирты – изомеры терпинеола:
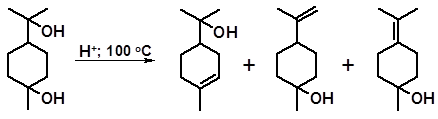
α-терпинеол β-терпинеол γ-терпинеол
Возможность осуществления частичной дегидратации объясняется тем, что терпинеолы в отличие от терпина относительно летучи и их удаляют из зоны реакции отгонкой с водяным паром. Терпинеолы (с преобладанием α-изомера) широко используются в качестве душистых веществ с запахом сирени и производятся промышленностью в больших масштабах.
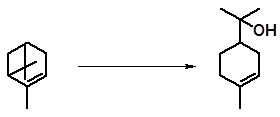 Существуют условия, когда гидратация лимонена, α-пинена, 3-карена непосредственно приводит к образованию терпинеола. Отечественная промышленность использует, например, гидратацию α- и β-пиненов водно-ацетоновым раствором серной кислоты и получает терпинеол в одну стадию:
Существуют условия, когда гидратация лимонена, α-пинена, 3-карена непосредственно приводит к образованию терпинеола. Отечественная промышленность использует, например, гидратацию α- и β-пиненов водно-ацетоновым раствором серной кислоты и получает терпинеол в одну стадию:
Н2О, ацетон, Н2SO4
α-пинен α-терпинеол
Гидратация протекает с образованием в качестве интермедиатов карбениевых ионов, отличающихся, как отмечалось ранее, большой склонностью к различного рода перегруппировкам. Следствием этого оказывается образование наряду с предполагаемыми продуктами гидратации соединений неожиданной структуры. Так, при гидратации α-пинена вместе с терпинеолом образуются примеси борнеола, изоборнеола и фенхолов – бициклических спиртов ряда камфана и фенхана.
Механизм их образования может быть представлен следующим образом. Первой ступенью является присоединение протона по двойной связи, с чего обычно начинается гидратация:

1
В катионе 1, прежде чем к нему присоединится молекула воды, может произойти перегруппировка, связанная с перемещением к атому углерода, несущему заряд, электронной пары от одного из соседних атомов углерода.
Ранее (см. 3.1.1.3) рассматривалось перемещение электронной пары водорода (гидридный сдвиг). В данном примере мы встречаемся с «алкильным сдвигом», т.е. с перемещением электронной пары, связывающей соседний атом углерода с другим атомом углерода, т.е. с алкильным радикалом.
Гидридный сдвиг в катионе 1 энергетически невыгоден, так как перемещение водорода от атомов 3 или 8 приводит к образованию менее стабильных карбениевых ионов – вторичного и первичного. По этой же причине не происходит алкильный сдвиг от атома 3, т.е перемещение электронной пары, связывающей атом 4 с атомом 3, к заряженному атому 2.
Перемещение водорода от атома 1 может привести к образованию третичного и, казалось бы, устойчивого карбениевого иона. На самом деле образующийся катион крайне неустойчив из-за напряжений, вызванных невозможностью расположения связей в данном катионе в одной плоскости, и реально не образуется (правило Бредта).
Практически происходит сдвиг одной из электронных пар, связывающих атом 1 с другими атомами углерода – алкильный сдвиг, который особенно легко протекает в бициклических структурах.
От атома 1 может перемещаться электронная пара, связывающая его с атомами 6 или 7. Рассмотрим оба варианта. Сдвиг электронной пары атомов 1-6 приводит к структуре фенхана:

1 2 2 фенхол
Превращение третичного катиона 1 в менее стабильный вторичный 2 оказывается термодинамически выгодным в связи с раскрытием напряженного четырехзвенного цикла и образованием ненапряженной бициклической структуры.
Сдвиг электронной пары атомов 1-7 образует структуру камфана:

борнеол + изоборнеол
Можно подобрать условия, в которых борнеолы оказываются основными продуктами гидратации.
Указанные превращения впервые описал русский ученый Е.Е. Вагнер; в органической химии они известны как перегруппировки Вагнера-Мейервейна.
Перегруппировки Вагнера-Мейервейна особенно характерны для камфена. Гидратация камфена лишь в мягких условиях позволяет получить нормальный продукт реакции – третичный спирт камфенгидрат:

камфен камфенгидрат
Обычными продуктами гидратации оказываются более термодинамически стабильные борнеол и изоборнеол, образующиеся в результате перегруппировок карбениевых ионов:

камфен 1 2изоборнеол борнеол
Данная перегруппировка носит название камфеновой перегруппировки первого рода. Она была открыта Вагнером, который, предположив ее протекание, впервые указал правильную структуру камфена. Камфеновая перегруппировка 1-го рода тем не менее не объясняла всех особенностей поведения камфена. В частности, оставалось неясным, почему при гидратации одного из энантиомеров камфена образуется рацемическая смесь, т.е. (±)-борнеол и (±)-изоборнеол. Перегруппировка 1-го рода затрагивает только один из двух хиральных центров камфена и рацемизация не должна происходить. Объяснение рацемизации при превращениях камфена дал академик С.С. Наметкин (1925). Он открыл иную последовательность превращений камфена, названную камфеновой перегруппировкой второго рода.
Камфеновая перегруппировка 2-го рода отличается тем, что в ней происходит двойной алкильный сдвиг: сначала перемещается электронная пара метильной группы, а затем идет перегруппировка, аналогичная перегруппировке 1-го рода:

1 11 2 1

Перегруппировка 2-го рода затрагивает второй хиральный атом в молекуле камфена. Одновременное протекание обеих перегруппировок приводит к рацемизации.
Еще одним важным в практическом отношении примером реакции гидратации является присоединение воды к цитронеллалю.
Гидратация цитронеллаля осуществляется в целях получения гидроксидигидроцитронеллаля (ГОЦ) - одного из широко известных душистых веществ. Особенностью процесса является невозможность непосредственной гидратации цитронеллаля, поскольку этот альдегид в присутствии кислот, т.е. в условиях гидратации, легко циклизуется в изопулегол (см. 3.1.3.1). Гидратацию осуществляют, предварительно инактивировав (защитив) карбонильную группу, например, реакцией с NaHSO3:

цитронеллаль ГОЦ
ГОЦ имеет сильный и приятный запах липы и ландыша с нотой зелени и в больших количествах используется в парфюмерии.
Гидратация пулегона интересна тем, что приводит к расщеплению молекулы по двойной связи. В особенности легко данный процесс протекает в присутствии муравьиной кислоты:

пулегон ацетон 3-метилциклогексанон
Реакция начинается с протонирования сопряженной системы по атому кислорода. Присоединение воды и перегруппировка образовавшегося енола завершают собственно процесс гидратации:

Присоединение протона по карбонильной группе кетоспирта вызывает сильное напряжение связи изопропильного радикала с циклом, которая разрывается под влиянием рядом расположенных акцепторов – кислорода и положительного заряда:

3.2.1.7 Присоединение галогеноводородов. Ненасыщенные терпеноиды с высокой скоростью присоединяют галогеноводороды. Реакция не требует катализатора, поскольку сами галогеноводороды являются сильными кислотами. Присоединение идет по правилу Марковникова. Например, при действии на лимонен соляной кислоты образуется двутретичный дигидрохлорид:

Гидрохлорирование, как и гидратация, часто сопровождается изомеризационными превращениями. Присоединение HCl к α-пинену только при температуре до минус 10 оС дает нормальный продукт присоединения:

t  -10 оС
-10 оС
Повышение температуры сопровождается изомеризацией (см. 3.2.1.6) с образованием борнил- и фенхилхлоридов:
 |
борнилхлорид, изоборнилхлорид
фенилхлорид
Присоединение HCl к камфену также вызывает перегруппировки (1-го и 2-го рода; см. 3.2.1.6) и приводит к борнил- и изоборнилхлориду.
В случае взаимодействия с HBr терпеноиды, как и другие алкены, могут давать продукты присоединения против правила Марковникова, что объясняется известным перекисным эффектом Хараша.
3.2.1.8 Присоединение карбоновых кислот. По механизму, аналогичному гидратации, с некоторыми ненасыщенными терпеноидами реагируют карбоновые кислоты, образуя сложные эфиры. Широко известна реакция камфена с уксусной кислотой, приводящая к получению изоборнилацетата – распространенного душистого вещества с хвойным запахом:

изоборнилацетат
Процесс катализируется серной кислотой и сопровождается перегруппировками (см. 3.2.1.6):

1 2
Взаимодействие уксусной кислоты с катионом 2 протекает стереоспецифично. Новая связь с атомом углерода, несущим положительный заряд, как известно, образуется по линии, перпендикулярной плоскости, в которой лежат связи карбениевого иона. Поскольку доступ молекулы уксусной кислоты по этой линии свободен только с одной стороны плоскости (с другой стороны крупной по размерам молекуле уксусной кислоты мешает плоскость второго пятизвенного цикла), образуется один диастереомер – изоборнилацетат:

изоборнилацетат
3.2.1.9 Полимеризация. Ненасыщенные терпеноиды, как и другие алкены, могут претерпевать полимеризацию. Особенно легко идет полимеризация при наличии сопряженных связей. Процесс катализируется кислотами (катионная полимеризация) или свободными радикалами. Полимеризация приводит к повышению вязкости, потере запаха и в химии душистых веществ является нежелательным процессом.
3.2.1.10 Присоединение формальдегида (реакция Принса). Реакция Принса – это взаимодействие алкенов с формальдегидом в среде уксусной кислоты в присутствии минеральных кислот.
Реакция протекает по механизму присоединения-отщепления. Особенностью механизма реации Принса является первоначальное присоединение протона не по двойной связи алкена, а по карбонильной группе формальдегида:
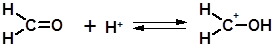
Полученный катион присоединяется по двойной связи в соответствии с правилом Марковникова. Процесс завершается отщеплением протона. Реакцию часто проводят в присутствии уксусной кислоты с этерификацией образовавшегося спирта.
Реакцию Принса используют в промышленности для получения некоторых душистых веществ из терпеновых углеводородов, например:

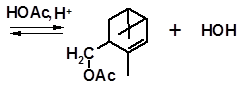
вальтерилацетат
Вальтерилацетат имеет древесно-травянистый запах и используется в парфюмерных композициях и отдушках для мыла.
3.2.1.11 Гидроксилирование двойных связей. Гидроксилированием алкенов называют присоединение гидроксильных групп с получением гликолей. Гидроксилирование осуществляют действием окислителей, таких как Н2О2, ОsО4, КМnО4. Использование раствора КМnО4 при комнатной температуре в слабощелочной среде для гидроксилирования двойных связей ввел в органическую химию Е.Е. Вагнер. С помощью этой реакции он установил структуры многих известных терпеноидов.
Окисление лимонена в подобных условиях приводит к образованию четырехатомного спирта с температурой плавления 191,5-192 ˚С.

Взаимодействие перманганата калия с α-пиненом, наряду с гидроксилированием двойной связи, вызывает раскрытие напряженного цикла и продуктом реакции также оказывается четырехатомный спирт:

|
из
5.00
|
Обсуждение в статье: Реакции двойных связей |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

