 |
Главная |
Реакции расщепления двойных связей. Озонолиз
|
из
5.00
|
Для двойных связей алкенов, наряду с реакциями присоединения, характерны реакции расщепления, т.е. полного разрушения двойной связи. Расщепление наблюдается при воздействии сильных окислителей и, в первую очередь, озона.
Реакцию с озоном используют для установления структуры ненасыщенного соединения. Озон первоначально присоединяется по двойным связям:

Продукт присоединения неустойчив и перегруппировывается с разрывом углерод-углеродной связи:

Образовавшийся озонид подвергают гидролизу, чем окончательно делят молекулу на фрагменты в соответствии с числом двойных связей. Гидролизом в присутствии восстанавливающего агента (например, тонко измельченного Zn) получают оксосоединения (альдегиды и(или) кетоны). При этом кислород связывается с каждым из атомов углерода, соединенных в исходном алкене двойной связью:

Полученные оксосоединения относительно легко идентифицировать и, следовательно, определить структуру всего алкена. Альдегиды нередко окисляют далее до кислот, если последние легче выделить и идентифицировать.
Озонолизом установлено строение многих терпеноидов. Л. Ружичка (1924г.) доказал положение двойных связей в природном мирцене, обнаружив среди продуктов озонолиза ацетон, формальдегид и оксосоединение сложной структуры, которое при последующем окислении образует янтарную кислоту:

мирцен озонид мирцена ацетон формальдегид 1
Окисление кетодиальдегида 1 приводит к янтарной кислоте:

1 янтарная кислота
Любая альтернативная структура мирцена приводила бы к иным продуктам процесса.
Расщепление двойных связей возможно также под действием других окислителей, например КМnО4, хромовой кислоты. Превращение линалоола в цитраль окислением дихроматом натрия в кислой среде, осуществляемое в промышленных масштабах, сопровождается образованием продуктов расщепления двойных связей – ацетона, метилгептенона, левулиновой кислоты:

линалоол гераниол цитраль

метилгептенон ацетон левулиновая
кислота
Расщепление двойных связей в данном случае является нежелательным побочным процессом.
Реакции замещения
Двойные связи в молекулах алкенов повышают реакционную способность расположенных рядом насыщенных атомов углерода. По этим атомам значительно легче, чем по всем остальным, протекают характерные для насыщенных систем реакции радикального замещения (SR). К подобным реакциям относятся имеющие большое значение в химии терпеноидов реакции окисления кислородом воздуха (автоокисление, самоокисление). Реакции носят цепной характер. Зарождение цепи связано с гомолитическим отщеплением от исходной молекулы атома водорода с образованием свободных радикалов. Отщепление происходит у соседнего с двойной связью атома углерода (α-атома) в связи с тем, что образующийся радикал стабилизируется за счет сопряжения с двойной связью (образуется сопряженный радикал аллильной структуры):

Продолжение цепи включает следующие превращения:


алкилгидроперекись
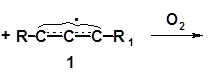 |
И т.д.
Разветвление цепи:


спирт 1
Спирт является первым устойчивым продуктом окисления.
Таким образом, самоокисление – это разветвленная цепная реакция, и она ускоряется с течением времени. Это необходимо учитывать при хранении эфирных масел и других ненасыщенных органических соединений.
Обрыв цепей связан с рекомбинациями радикалов. Два перекисных радикала могут дать тетроксид, распадающийся затем на кетон и спирт:


Возможны и другие варианты рекомбинации радикалов.
Следует отметить, что цепи при самоокислении оказываются достаточно длинными – порядка 104 актов взаимодействия.
Приведенные превращения радикалов не являются единственными.
Так, перекисные радикалы могут распадаться на два фрагмента - альдегид и спиртовый радикал:

Спиртовые радикалы, в свою очередь, образуют новые цепи. Альдегиды затем окисляются до карбоновых кислот. Приведенные процессы усложняют состав продуктов окисления.
Спирты, образовавшиеся на начальной стадии процесса, могут окисляться далее по аналогичному механизму до оксосоединений и кислот (если спирт первичный). Таким образом, самоокисление является причиной возрастания кислотного числа при хранении терпеноидов.
Свободные радикалы, образующиеся при окислении ненасыщенных соединений, могут также присоединяться по двойной связи исходного алкена, образуя димеры. Последние с новой молекулой алкена образуют тримеры и т.д., т.е. радикалы вызывают полимеризацию ненасыщенных соединений. Это приводит к повышению вязкости массы, а в тонком слое – к образованию твердой пленки («высыханию» пленки). На этом свойстве основано использование терпеноидов (например, соснового скипидара) в лакокрасочной промышленности.
Среди терпеноидов особенно легко окисляются воздухом соединения, в молекулах которых имеется насыщенный атом углерода, расположенный между двойными связями. В этом случае стабилизация зарождающегося радикала наиболее эффективна, и он образуется особенно легко. Подобной структурой обладает, например, оцимен:

Замечено, что оцимен очень быстро окисляется и полимеризуется на воздухе, превращаясь в смолообразную массу.
В ряде случаев окисление терпеноидов воздухом используют для превращения углеводородов в кислородсодержащие производные, ценящиеся как душистые вещества. Из лимонена таким способом получают карвон:

карвеол карвон
Окисление α-пинена воздухом при облучении ультрафиолетовым светом приводит к вербенолу, миртенолу и далее к соответствующим оксосоединениям:

вербенол миртенол
 |
вербенон миртеналь
Реакции спиртов
Характерные химические свойства спиртов определяются гидроксильной группой – функциональной группой данного класса органических соединений. Возможны два варианта разрыва связей с участием группы –ОН:

 – разрыв связи углерод - кислород ( ) с отщеплением гидроксильной группы;
– разрыв связи углерод - кислород ( ) с отщеплением гидроксильной группы;
– разрыв связи кислород - водород ( ) с отщеплением водорода.
Это могут быть реакции замещения, в которых вместо уходящих атомов появляются другие атомы или группы, или элиминирования (отщепления), приводящие к образованию двойной связи. Участие группы -ОН в изомеризационных превращениях терпеновых спиртов рассмотрено ранее.
 3.3.1 Реакции с разрывом связи
3.3.1 Реакции с разрывом связи
К реакциям с разрывом связи углерод-кислород относятся реакции замещения и отщепления воды (дегидратации). Некоторые особенности протекания данных реакций, известные в ряду терпеновых спиртов, обусловлены строением радикала R.
3.3.1.1 Реакции замещения. Для терпеновых, как и других спиртов, характерны реакции замещения группы ОН на галоген. Особенно легко реагируют спирты аллильной структуры и третичные спирты. Процесс здесь протекает по механизму SN1:
 |
Быстро
 |
Медленно
3.  – быстро
– быстро
В случае вторичных спиртов катион R+ менее устойчив и труднее образуется, что объясняет значительно меньшую скорость замещения. Первичные спирты реагируют по-иному, без образования карбениевого иона. Здесь реализуется одностадийный механизм замещения SN2; процесс идет относительно медленно:

Иллюстрацией приведенных закономерностей может служить взаимодействие галогеноводородов с гераниолом, терпинеолом и цитронеллолом. Гераниол (спирт аллильной структуры) легко превращается в геранилхлорид при пропускании хлороводорода через толуольный раствор гераниола (температура около 100 °С):

гераниол геранилхлорид
Цитронеллол (первичный спирт) в этих условиях не реагирует.
Очень легко замещает гидроксильную группу на галоген третичный спирт терпинеол.
В ряду моноциклических вторичных терпеновых спиртов замещение протекает легче у изомеров, где группа ОН находится на аксиальной связи. Так, неоментол в реакциях замещения значительно активнее, чем ментол. Это соответствует общим закономерностям реакций SN у производных циклогексана.
Интересно сильное различие скоростей замещения ОН-группы у борнеола и изоборнеола. Изоборнеол легко замещает гидроксильную группу на галоген, тогда как борнеол – с большим трудом. Так, взаимодействие изоборнеола с FeCl3 в эфире протекает быстро и приводит к продукту замещения. При использовании борнеола замещения не происходит, и он в условиях реакции окисляется ионом Fe3+ в камфору.
Поскольку процесс по механизму SN1 протекает с образованием карбениевых ионов в качестве интермедиатов, он может сопровождаться перегруппировками, характерными для этих ионов. Так, при взаимодействии линалоола с HCl образуется в основном не линалилхлорид, а геранилхлорид – продукт аллильной перегруппировки:
 линалоол геранилхлорид
линалоол геранилхлорид
Преимущественное образование геранилхлорида связано с большей термодинамической стабильностью этого соединения.
3.3.1.2 Реакции дегидратации. Дегидратация спиртов, т.е. отщепление воды от спирта с образованием алкена, является реакцией, обратной реакции гидратации алкенов, рассмотренной ранее. Дегидратация, как и гидратация, катализируется кислотами. Процесс проводят при нагревании, что увеличивает скорость реакции и способствует смещению равновесия вправо (дегидратация – эндотермический процесс; ΔН>0).
Механизм дегидратации спиртов выглядит следующим образом:

спирт 1алкен
Процесс идет через образование катиона 1 и является примером реакций элиминирования типа Е1. Дегидратация протекает тем быстрее, чем стабильнее карбениевый ион 1. Поэтому легко отщепляют воду третичные спирты и спирты аллильной структуры, значительно труднее – вторичные спирты и наиболее трудно – первичные.
В ходе дегидратации возможны изомеризационные превращения, усложняющие состав, что объясняется склонностью карбениевых ионов к перегруппировкам.
Среди ациклических терпеновых спиртов легко отщепляют воду спирты аллильной структуры – гераниол, нерол, линалоол. Легче всего реагирует линалоол, у которого спиртовая группа связана с третичным атомом углерода. Состав продуктов дегидратации сложен и зависит от условий процесса. Под действием кислоты происходит отщепление воды с образованием сопряженных катионов аллильной структуры, отличающихся пространственным расположением сопряженной системы:

1 2
Катионы 1 и 2 после отщепления протона образуют геометрические изомеры мирцена и оцимена.

1Z-оцимен E-мирцен
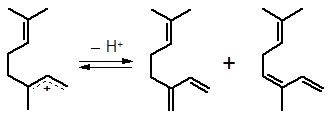
2Z-мирцен E-оцимен
Катион 1 легко циклизуется, что приводит к моноциклическим углеводородам ряда пара-ментана:

1дипентен терпинолен
Дипентен и терпинолен далее могут изомеризоваться и в другие моноциклические углеводороды (см. 3.1.1).
Процесс циклизации необратим, поэтому при проведении дегидратации в жестких условиях с длительной выдержкой (т.е. с термодинамическим контролем) основными продуктами оказываются дипентен и другие моноциклические углеводороды.
Аналогично идет дегидратация гераниола и нерола, хотя процесс протекает несколько медленнее.
Легко отщепляют воду α-, β-, γ-терпинеолы, терпиненолы (третичные спирты), карвеол (спирт аллильного типа) и другие подобные спирты. Реакция идет количественно и используется в аналитических целях для определения спиртов в составе эфирных масел. Дегидратацию ведут в присутствии серной или толуолсульфокислоты (~ 1 % от массы спирта), в кипящем толуольном растворе (температура кипения 120-130 ºС). Количество воды определяют по объему, отгоняя ее из реакционной массы в виде азеотропа с толуолом, или титрованием с помощью реактива Фишера (раствор I2 и SО2 в пиридине и метаноле).
Вторичные спирты подвергаются дегидратации гораздо труднее. Исключение составляет изоборнеол, который ведет себя как третичный спирт и может быть определен методом дегидратации. Это связано с пространственной структурой изоборнеола. Механизм процесса может быть представлен следующим образом:

изоборнеол 1 2 2 камфен
 Отщепление воды от протонированной молекулы изоборнеола происходит одновременно с перегруппировкой углеродного скелета молекулы (структура камфана переходит в структуру изокамфана). При этом перемещающаяся электронная пара выталкивает молекулу воды сзади, действуя вдоль линии связи , как это происходит в реакциях SN2. В результате перегруппировка облегчает разрыв связи углерод-кислород и одновременно приводит к образованию устойчивого третичного катиона 2, как и при дегидратации третичных спиртов. В этой связи весь процесс дегидратации протекает так же легко, как и у третичных спиртов. Описаны примеры проведения дегидратации изоборнеола в присутствии таких мягких катализаторов, как гидросульфат натрия и уксусная кислота.
Отщепление воды от протонированной молекулы изоборнеола происходит одновременно с перегруппировкой углеродного скелета молекулы (структура камфана переходит в структуру изокамфана). При этом перемещающаяся электронная пара выталкивает молекулу воды сзади, действуя вдоль линии связи , как это происходит в реакциях SN2. В результате перегруппировка облегчает разрыв связи углерод-кислород и одновременно приводит к образованию устойчивого третичного катиона 2, как и при дегидратации третичных спиртов. В этой связи весь процесс дегидратации протекает так же легко, как и у третичных спиртов. Описаны примеры проведения дегидратации изоборнеола в присутствии таких мягких катализаторов, как гидросульфат натрия и уксусная кислота.
 В случае борнеола, у которого пространственное положение гидроксильной группы иное, синхронное отщепление воды и перегруппировка невозможны, так как перемещающаяся электронная пара и связь не могут оказаться на одной линии, и процесс по типу SN2 невозможен. Реакция идет ступенчато через трудно образующийся вторичный карбениевый ион 3 и поэтому медленно:
В случае борнеола, у которого пространственное положение гидроксильной группы иное, синхронное отщепление воды и перегруппировка невозможны, так как перемещающаяся электронная пара и связь не могут оказаться на одной линии, и процесс по типу SN2 невозможен. Реакция идет ступенчато через трудно образующийся вторичный карбениевый ион 3 и поэтому медленно:
 |
- медленно
Катион 3 быстро перегруппировывается в более стабильную структуру 2 и конечным продуктом дегидратации изоборнеола также оказывается камфен:

3 2 2 камфен
Дегидратация борнеола наблюдается лишь в жестких условиях - при нагревании с серной кислотой концентрацией 50 % и выше.
Первичные спирты – цитронеллол, лавандулол – к дегидратации весьма устойчивы.
 |
|
из
5.00
|
Обсуждение в статье: Реакции расщепления двойных связей. Озонолиз |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

