 |
Главная |
Пример 2. Кинетика химических процессов
|
из
5.00
|
В общем случае скорость химической реакции зависит от концентрации реагирующих веществ. Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, влияющего на скорость, называется кинетическим дифференциальным уравнением химического процесса. Рассмотрим химические процессы первого порядка.
Скорость, реакции первого порядка выражается уравнением:
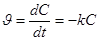 , (1)
, (1)
где C- концентрация реагирующего вещества: ;
k- постоянная скорости реакции.
Минус в уравнении (1) означает, что концентрация реагирующего вещества с течением времени убывает.
В дифференциальном уравнении (1) разделим переменные и проинтегрируем его:
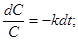
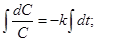
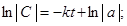
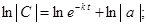
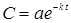 ,
,
где a- постоянная интегрирования.
Полагая при t=0, C=C0, получаем a=C0, следовательно,
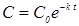 , (2)
, (2)
где С0 – начальная концентрация реагирующего вещества.
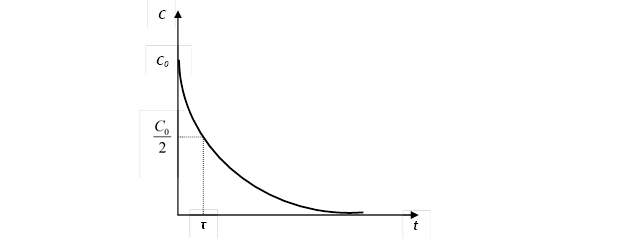
Рис 2. График изменения концентрации вещества, вступающего в реакцию, от времени.
Формула (2) выражает закон химической реакции первого порядка в интегральной форме. Пользуясь уравнением (2), можно определить время, за которое концентрация исходного вещества уменьшается на половину. Это время называют периодом полупревращения или полупериодом протекания реакции и обозначают t.
Подставив значения t=t, 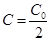 в уравнение (2), получим:
в уравнение (2), получим:
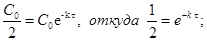
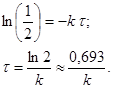
Таким образом, период полупревращения не зависит от исходной концентрации вещества, и за равные промежутки времени расходуется одна и та же доля вещества.
Пример3. Закон растворения лекарственных форм вещества из таблеток
Скорость растворения лекарственных форм вещества из таблеток пропорциональна количеству лекарственных форм вещества в таблетке.
Необходимо установить зависимость изменения количества лекарственных форм вещества в таблетке с течением времени.
Обозначим через m количество вещества в таблетке, оставшееся ко времени растворения t.
Тогда 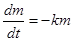 (1),
(1),
где k - постоянная скорости растворения.
Знак минус означает, что количество лекарственных форм вещества с течением времени убывает.
В дифференциальном уравнении (1) разделим переменные и проинтегрируем его:
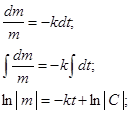
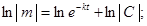
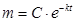 .
.
Полагая, что при t=0 m=m0,, получаем C=m0, следовательно,
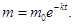 (2)
(2)
где m0 – начальная масса лекарственных форм вещества в таблетке.
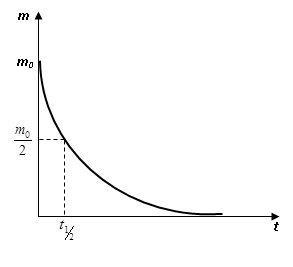
Рис 3. График изменения количество лекарственного вещества в таблетке от времени.
Формула (2) выражает закон растворения лекарственных форм вещества из таблеток в интегральной форме.
Из уравнения (2) находят постоянную скорости растворения k:
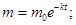
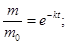
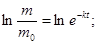
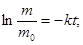
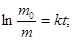
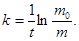
Период полурастворения таблеток 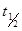 рассчитывают из формулы (2) при
рассчитывают из формулы (2) при 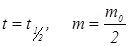 .
.
Тогда 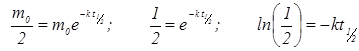 .
.
Откуда 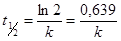 .
.
|
из
5.00
|
Обсуждение в статье: Пример 2. Кинетика химических процессов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

