 |
Главная |
Изменения содержания объема общего кальция, неорганического фосфора и активности щелочной фосфатазы в сыворотке крови при заболеваниях костной
|
из
5.00
|
Системы

При портальном циррозе печени повышенная активность щелочной фосфатазы сочетается с повышением содержания билирубина в крови.
При алиментарных остеодистрофиях важное диагностическое значение имеет определение индекса активности щелочной фосфатазы в динамике (активность щелочной фосфатазы в мг% в 1 ч при 37 °С/неорганический фосфор сыворотки крови в мг%).
Для выражения активности щелочной фосфатазы предложено много величин (единицы активности Боданского, Кинга и Армстронга, Бесси, Лоури, Брока и др.). Между ними существует следующая зависимость:
nВɛ = [0,5 + 0,4] • ВαВɛ; nВɛ = [2,1n - 0,7] • КАɛ;
nКАɛ = [0,48п + 0,4] • Вɛ; nКАɛ = [0,24 + 0,8] • ВαВɛ;
nВαВɛ = [4,2п - 2,5] • КАɛ; nВаВɛ = [2n - 0,8] • Вɛ,
где n — число подлежащих пересчету единиц.
Пересчет активности в международные единицы (µМол/мин/ 1000мл, 37 °С) можно произвести путем умножения Вɛна 5,35; КАɛ на 1,8 и ВαВɛ на 16,7.
При расчетах необходимо исходить из следующих соотношений:αγ

Следует также отметить, что кроме гидролитической функции фосфатазы обладают также способностью переносить фосфатные остатки, т. е. функцией трансферазы. Донорами в таких реакциях служит ряд эфиров (фосфокреатин, глюкозо-1-фосфат, п-нитро-фенилфосфат и др.). Акцепторами остатков фосфорной кислоты могут быть простые спирты, глицерин, фруктоза, глюкоза и др. Однако в настоящее время недостаточно ясно, какое значение имеют реакции подобного типа и в какой степени они могут быть использованы в диагностическом отношении, так как реакции, катализируемые фосфатазами, являются равновесными, причем это равновесие так далеко смещено в направлении гидролиза, что маловероятно, чтобы эти реакции синтеза фосфатных эфиров имели значительное физиологическое значение.
Активность щелочной фосфатазы в сыворотке крови определяют по И. М. Белякову. Принцип метода основан на способности фермента отщеплять при рН 8,6 и температуре 37 °С неорганический фосфор от фосфорного эфира (3-глицерофосфата натрия. Определение активности щелочной фосфатазы заключается в установлении разности между содержанием неорганического фосфора (с использованием аскорбинового редуцента) в сыворотке крови до и после инкубации с ᵦ-глицерофосфатом натрия. Активность фермента выражается в единицах Боданского. Одна единица соответствует 1 мг фосфора, отщепляемого под действием фермента в течение 1 ч при температуре 37 °С.
Диастаза(α-амилаза). Определение ее активности в сыворотке крови нашло широкое применение при диагностике заболеваний поджелудочной железы. Патогномоничность этого теста сделала его ценным методом дифференциации особенно острых панкреатитов от колик, связанных с желчно-каменной болезнью, язвами желудка и кишок, острой непроходимостью кишечника. При остром панкреатите активность энзима возрастает в 10—30 раз по сравнению с исходным уровнем. При некротических панкреатитах активность диастазы падает, так как пораженная некрозом поджелудочная железа теряет способность продуцировать энзим.
Уровень диастазы в крови понижается также при сахарном диабете, тяжелых ожогах, тиреотоксикозе, отравлении хлороформом, четыреххлористым углеродом, барбитуратами, после тяжелых операций. Повышается он при воспалениях слюнных желез, остром и хроническом холецистите, токсических гепатитах, циррозе печени.
Одновременное определение активности диастазы в крови и моче оказалось важным для суждения о состоянии почечной функции, так как нефрозы, гломерулонефриты, нефроциррозы и т. п. обычно сопровождаются увеличением активности этого энзима в крови, в то время как содержание его в моче резко снижается. Таким образом коэффициент активность амилазы крови/активность амилазы мочи может служить критерием функциональной полноценности почек.
Активность диастазы сыворотки крови определяют по методу Вольгемута. В тех пробирках, где крахмал не расщепился полностью, жидкость остается окрашенной в синий цвет, а в пробирках, в которых крахмал под действием диастазы превратился в декстрин, — окрашивается в фиолетовый или желтоватый цвет. Допустим, что содержимое шестой пробирки окрасилось в синий, а пятой — в фиолетовый цвет. Тогда результат определяют по пятой пробирке, в которой, например, было разведение 1 : 32. Разведение умножают: 32 : 2 = 64. Норма активности по этой методике около 32.
Альдолазакатализирует реакции расщепления промежуточного продукта окисления углеводов— 1,6-дифосфорного эфира фруктозы — на фосфотриозы. Фермент осаждается спиртом и ацетоном, в высушенном состоянии длительно сохраняет свою активность. Хорошо растворяется в воде и легко экстрагируется ею из ацетонового порошка. Альдолаза довольно стабильна, не разрушается в течение 10 мин при 50 °С и инактивируется при нагревании выше 60—70 °С.
Энзим относительно малочувствителен к небольшим изменениям рН среды. Оптимум его активности зависит от температуры, рН и наличия в среде ингибиторов и активаторов.
Для определения активности альдолазы в сыворотке крови существует несколько методов, основанных на различных принципах.
Саблей и Лянингер разработали наиболее простой метод определения активности альдолазы, основанный на образовании 2,4-динитрофенилгидразинов фосфотриоз и колориметрическом измерении экстинкции раствора, образующейся при добавлении щелочи при светофильтре 540 нм. Интенсивность окраски пропорциональна концентрации фосфотриоз. Дауне, Барнет и Байер, а затем Брукс и сотр. усовершенствовали этот метод.
Повышение активности альдолазы отмечается при мышечных дистрофиях (некроз сердечной мышцы), декомпенсированныхпороках сердца, инфаркте, поражении печени при отравлении четыреххлористым углеродом (остром гепатите), механической желтухе.
В эритроцитах здоровых животных альдолазы в 70—80 раз больше, чем в сыворотке крови, поэтому гемолизированная кровь совершенно непригодна для анализа сыворотки на активность альдолазы.
Лизоцим(мурамидаза) в организме животных находится в крови (сыворотка, плазма, лейкоциты, тромбоциты), слезах, слюне, выделениях из носа, бронхов, желудочном и кишечном соке, молоке, влагалищном секрете, сперме, экссудатах брюшной полости, плевры и в моче. Небольшие количества имеются в экскретах.
Лизоцим обладает выраженными бактериостатическими свойствами. К его действию весьма чувствительны Вас. micrococcus, staphylococcus, streptococcus, proteus, но резистентны грамотрицательные микробы. Лизоцим обладает сильным антибактериальным действием на грамположительные микробы в среде, содержащей угольную кислоту (Н2СО3) и диоксид углерода (СО2). В присутствии комплемента и специфических антител лизоцим действует также и на грамотрицательные микробы.
Предложено два метода определения активности лизоцима — бактериологический (биологический) и вискозиметрический. При первом методе (Флеминга) измеряется интенсивность уменьшения получения суспензии из Micrococcus lysodeicticus под влиянием лизоцима. Это весьма простой метод, однако менее точный, чем вискозиметрический, основанный на измерении снижения вязкости в полисахаридном субстрате. Единицей активности лизоцима считается количество препарата, которое в течение 10 мин снижает вязкость полисахаридного раствора наполовину. 0,73 у кристаллического лизоцима из яичного белка содержит одну единицу активности лизоцима.
Карбоангидразакатализирует обратимую реакцию: СО2 + Н2О <-> Н2СО3 <-> Н+ + НСО3-.
Карбоангидраза получена в кристаллическом виде из эритроцитов. Энзим теряет активность после нагревания до 60—65 °С через 30 мин. Это один из наиболее активных ферментов: одна его молекула может в течение 1 с произвести гидратацию 45 000 молекул диоксида углерода. Оптимум ее активности находится в пределах рН 5,0-9,0.
Основная функция карбоангидразы эритроцитов — стимуляция отдачи СО2 в легких и ускорение приема СО2 из тканей организма в кровь. Особенно важную роль выполняет Карбоангидраза в почках при резорбции ионов натрия и поддержании щелочного резерва крови.
Образующийся при обменных процессах диоксид углерода переводит энзим в угольную кислоту (Н2СО3), которая затем диссоциирует на Н+ и НСО3-. В 10 мл крови животных содержится 14— 18ед. карбоангидразы (по Раутану и Мальдруму). После деления числа единиц карбоангидразы на показатель гематокрита получается так называемый индекс карбоангидразы, который у здоровых особей составляет 0,32—0,39 и имеет весьма высокую стабильность.
Активность карбоангидразы понижена при анемиях, однако индекс карбоангидразы при этом обычно повышен как показатель увеличения насыщенности эритроцитов энзимом по сравнению с нормой. Снижение карбоангидразной активности бывает при де-компенсированных пороках сердца, сопровождающихся общим цианозом, а также при желтухе.
Активность карбоангидразы крови определяют по методу Мальдрума и Раутана. Единица активности — количество фермента, сокращающее в стандартных условиях время реакции наполовину.
Рибонуклеазапредставляет собой термостабильный фермент, расщепляющий рибонуклеиновую кислоту (РНК). Она имеется в поджелудочной железе, панкреатическом соке, печени, селезенке, почках и полиморфноядерных лейкоцитах. Для ДНК она неактивна. Температурный оптимум рибонуклеазы близок к 60 °С, а рН около 7,6 (активность сохраняется при рН от 5,0 до 6,0). Активатором энзима являются ионы магния. При 85 °С активность фермента исчезает, но после охлаждения полностью восстанавливается. При лейкемиях содержание рибонуклеазы в моче повышается, а в сыворотке крови удерживается в пределах нормы. Повышение активности рибонуклеазы сыворотки крови выражено при уремии.
Активность рибонуклеазы сыворотки крови определяют по методу Куница, а также Фирса и Миллера.
Пептидазы(карбоксипептидаза, аминопептидаза, пролиназа и пролидаза) принадлежат к пептидазам, катализирующим гидролиз продуктов распада белков — полипептидов, под действием которых они гидролизуются до аминокислот. Пептидазы вырабатываются в слизистой оболочке тонких кишок и выделяются с кишечным соком. В составе пептидаз обычно выделяют карбоксипепти-дазу, аминопептидазу, пролиназу и пролидазу, обладающие большой специфичностью действия.
Повышение уровня пептидаз в крови отмечается при массивных поражениях тканей (обширные ожоги), лобарной пневмонии, переломах костей, раке и лейкемиях. Повышение их активности обычно имеет место при острых и подострых воспалениях печени, обтурационной желтухе, гломерулонефрите, что широко используется при их диагностике. После обработки четыреххлористым углеродом отмечается закономерное повышение зеркала пептидаз в крови жвачных.
Определение активности карбоксипептидазы основано на способности ее освобождать карбоксильные группы, прирост содержания которых определяется титрометрически. Ход определения: в две колбочки (проба и контроль) вносят по 1 мл препарата фермента и 10 мл буферного раствора с рН 8,0. Содержимое контроля нагревают до кипения. В обе колбочки вносят по 5 мл гидролизата эдестина и ставят в термостат при 37 °С на 1 ч, затем нагревают до кипения. В обе колбочки вносят по 0,5 мл 0,1%-ного раствора фенолфталеина и титруют до одинаково розовой окраски 0,02 н. раствором натрия гидроксида (едкого натрия).
За единицу активности карбоксипептидазы принимают активность, при которой за 10 мин освобождается такое количество карбоксильных групп, которое соответствует 1 мл 0,02 н. раствора натрия гидроксида.
Определение активности аминопептидазы сыворотки крови методом Грина в модификации Гольдберга основано на колориметрическом вычислении количества р-нафталамина, освобожденного аминопептидазой из субстрата α-лейцин-β-нафтиламида.
Глютаматдегидрогеназа.Определение ее активности основано на том, что дегидрогеназа катализирует обратимую реакцию превращения α-кетоглютаминовой кислоты в α-кетоглютаровую. На стадии α-кетоглютаровой кислоты в цикле трикарбоновых кислот возможен выход этой кетокислоты из цикла и превращение ее в α-глютаминовую кислоту посредством аминирования за счет свободного аммиака или обратимой реакции переаминирования.
Фермент содержится прежде всего в печени, миокарде, почках. Содержание дегидрогеназы глютаминовой кислоты (глютаматдегидрогеназы) в лейкоцитах при лимфоидном и миелоидном лейкозах в 4—5 раз выше, чем у здоровых животных, но повышается при заболеваниях печени (гепатит, цирроз), отравлении четыреххлористым углеродом.
Методика определения активности глютаматдегидрогеназы основана на ее воздействии на глютаминовую кислоту при рН 7,6 и температуре 37 °С в присутствии никотинамидадениндинуклеотида. Увеличение экстинкции при 340 нм во время перехода оксидированной формы кофермента в редуцированную является пропорциональным концентрации фермента.
Фруктозо(кетозо)-1-фосфатальдолазасодержится в клетках печени наряду с 1,6-дифосфатальдолазой (альдолазой) и расщепляет фруктозо-1-фосфат на фосфодиоксиацетат и альдегид глицерина. У здоровых животных фруктозе-1-фосфатальдолаза обычно отсутствует или имеется в незначительных количествах, но обнаруживается в сыворотке крови при остром гепатите, что является важным диагностическим тестом в подобных случаях, более ранним, чем повышение активности альдолазы. Кроме того, альдолаза в отличие от этого энзима обнаруживается в различных органах при их патологии. Следует отметить, что появление и повышение активности фруктозо-1-фосфатальдолазы в сыворотке крови свидетельствует о поражении паренхимы печени при условии, что исключается заболевание почек, также вызывающее активизацию этого фермента. По зеркалу фруктозо-1-фосфатальдолазы в сыворотке крови можно судить о течении болезни, при наступающем выздоровлении ее активность снижается и исчезает совсем. Активность фермента обычно измеряют по степени превращения восстановленной формы никотинамидадениндинукле-отида (НАД • Н) в никотинамидадениндинуклеотид (НАД) в параллельной обменной реакции:

Активность сывороточной фруктозо-1-фосфатальдолазы определяют с помощью оптического теста Варбурга.
Креатинфосфокиназа(креатинкиназа) катализирует обратимую реакцию:

Она содержится только в мышечной ткани, особенно поперечнополосатой, что делает повышение ее активности патогномонич-ным для повреждения миокарда, а также скелетных мышц. Инфекционные и токсические миокардиты обычно протекают со значительной гиперкреатинфосфокиназемией.
Активность креатинфосфокиназы в сыворотке крови определяют по методу Миллера. Принцип метода состоит в образовании в сильнокислой среде креатина и фосфата из креатинфосфата. Затем колориметрически измеряют образовавшийся при этом органический фосфат.
За единицу активности креатинфосфокиназы принимают ферментную активность 1 мл сыворотки крови, которая в стандартных условиях расщепляет за 1 мин 1 мкмоль/л фосфокреатина, определенного в виде неорганического фосфата.
Определение активности креатинфосфокиназы в сыворотке крови по методу Эннера и Розенберга в модификации Гринио и Консисторума основано на образовании под действием фермента креатина из сыворотки крови в инкубационной смеси, содержащей креатинфосфат и АДФ. Креатин определяют посредством цветной реакции с α-нафтолом и диацетилом. Об активности энзима судят по количеству образовавшегося креатина, измеряя интенсивность окраски реактивов.
Активность энзима пропорциональна разности экстинкций между опытным и контрольным определениями. Расчет производят по стандартной кривой, построенной по креатину. За единицу активности принимают ферментную активность, при которой в 0,1 мл сыворотки в течение 30 мин при 37 °С образуется 1 мкг креатина. В норме активность составляет 0,2—4,0 ед.
Сорбитдегидрогеназа(алкогольдегидрогеназа) катализирует обратимую реакцию:

Оптимум активности фермента отмечается при рН 8,0. В больших количествах он содержится лишь в печени. В сыворотке крови здоровых животных фермент отсутствует. Будучи специфическим для печени ферментом, он имеет большое клиническое значение в диагностике гепатитов, особенно остропротекающих. Следует учитывать, что показатели активности фермента при гепатитах приходят к норме раньше, чем показатели активности трансаминаз.
Сорбитдегидрогеназу в сыворотке крови определяют с помощью оптического теста Варбурга.
Малатдегидрогеназа(дегидрогеназа яблочной кислоты) катализирует последний этап трикарбонового (аэробного) цикла Кребса при участии коэнзима НАД:
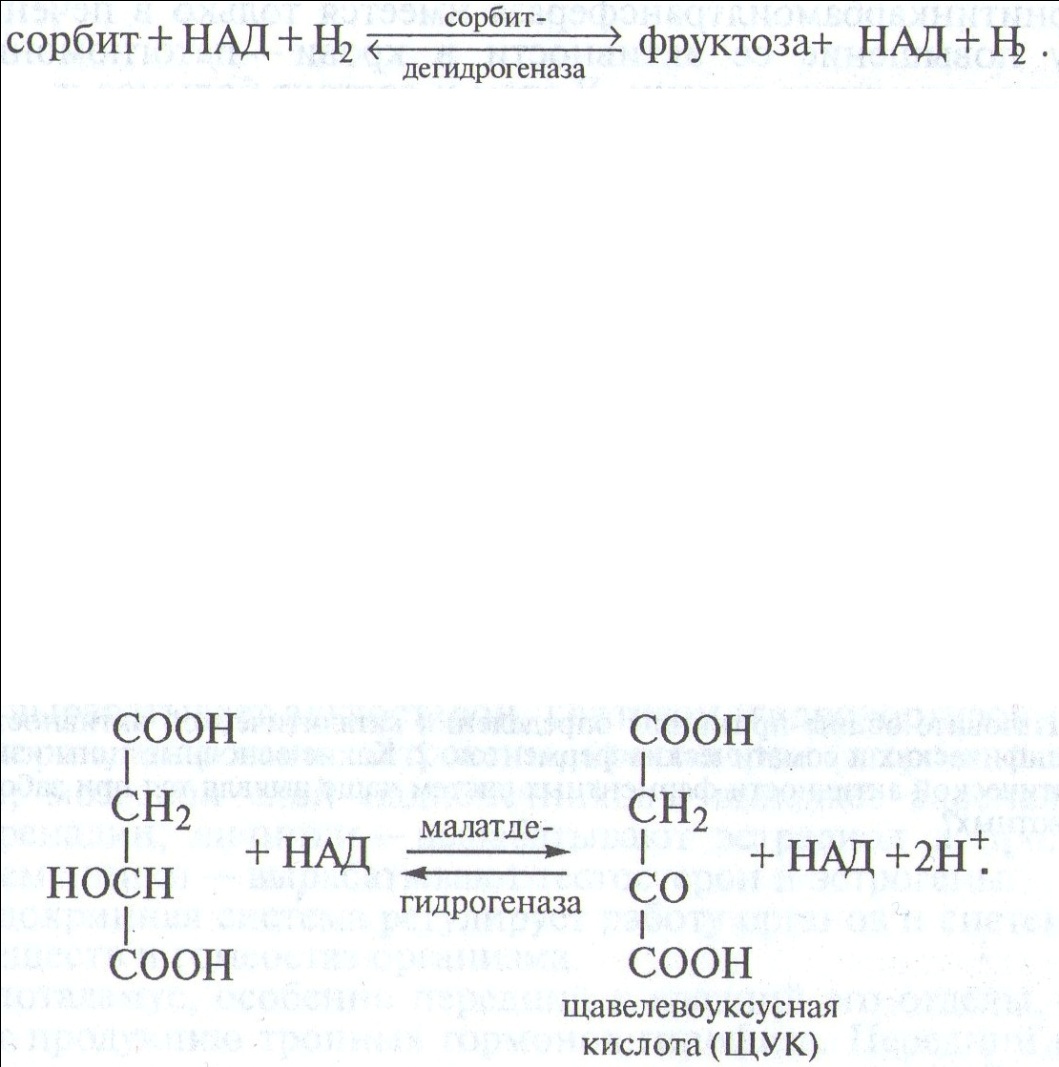
Максимальная активность реакции проявляется при концентрации яблочной кислоты, равной 0,03 М, а полумаксимальная — при 0,01 М.
Увеличение концентрации фермента в сыворотке крови обнаруживают при заболеваниях печени, тиреотоксическом зобе, остром и хроническом нефрите, лимфогранулематозе, а также во время беременности. При гепатите активность фермента повышается в 10 раз и более. Значительное повышение отмечают также при инфарктах миокарда уже через 12—42 ч после заболевания.
Активность малатдегидрогеназы в сыворотке крови определяют с помощью оптического теста Варбурга.
 Орнитинкарбамоилтрансферазакатализирует первый этап цикла превращений мочевины (орнитина):
Орнитинкарбамоилтрансферазакатализирует первый этап цикла превращений мочевины (орнитина):
В присутствии карбамоилфосфата орнитин переходит в цитрулин.
Орнитинкарбамоилтрансфераза имеется только в печени, поэтому повышение ее активности в крови — патогномоничный признак поражения печени. В этом и состоит большое клиническое значение исследования активности этого фермента.
Активность орнитинкарбамоилтрансферазы в сыворотке крови определяют по методу Райхарда в модификации Морети. Принцип метода состоит в том, что фермент катализирует арсенолиз цитрулина до орнитина и аммиака:

В качестве субстрата берут цитрулин и по количеству образовавшегося аммиака с помощью реактива Несслера судят об активности энзима.
Контрольные вопросы и задания
1. Назовите общие принципы определения каталитической активности органоспецифических и соматических ферментов. 2. Какие основные типы изменения каталитической активности ферментных систем чаще выявляются при заболеваниях животных?
Глава 11
|
из
5.00
|
Обсуждение в статье: Изменения содержания объема общего кальция, неорганического фосфора и активности щелочной фосфатазы в сыворотке крови при заболеваниях костной |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

