 |
Главная |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
|
из
5.00
|
Бактериальный ожог плодовых – возбудитель бактерия Erwinia amylovora.
Бактериальный ожог – одно из наиболее опасных инфекционных заболеваний плодовых культур. Данное заболевание является карантинным для территории Республики Казахстан и входит в список А2 Перечня ЕОКЗР (т.е. является ограниченно распространенным в нашей стране).
Изначально, данное заболевание было зарегистрировано в Америке, в 1780 году. Затем получило значительное распространение в Северной Америке, Европе, Азии. Постепенно распространяясь, заболевание достигло почти всех континентов. Такая распространенность заболевания в широких географических и климатических диапазонах может свидетельствовать об экологической пластичности возбудителя. Следовательно, угроза расширения ареала болезни будет сохраняться.
В настоящее время очаги бактериального ожога выявлены на юге и юго-востоке Казахстана, т.е. в основных зонах плодоводства республики. Наличие очагов болезни создает угрозу массового распространения её на территории страны. Патоген способен длительное время сохраняться в латентном состоянии и при благоприятных внешних условиях, быстро распространяться и вызывать эпифитотии. Климатические условия юго-востока Казахстана благоприятны для акклиматизации и обоснования патогена. Следовательно, возникает необходимость постоянного мониторинга по выявлению очагов заболевания и идентификации его возбудителя, с целью предотвращения дальнейшего его распространения.
Распространенность.
Как отмечалось ранее, впервые заболевание было зарегистрировано в Америке в 1780 г. Постепенно распространяясь оно достигло почти всех континентов и в настоящее время зарегистрировано [6]:
Европа: Бельгия, Болгария, Кипр, Словакия, Дания, Франция, Германия, Греция, Ирландия, Италия, Люксембург, Нидерланды, Норвегия, Польша, Швеция, Швейцария, Великобритания (включая Северную Ирландию), Югославия.
Азия: Армения, Турция, Китай (не подтверждено), Израиль, Ливан, Корейская Республика (не подтверждено), Саудовская Аравия (не подтверждено), Вьетнам (не подтверждено), Индия (1978 г., на розах и поэтому сомнительно). Обнаружение бактериального ожога в Японии является ошибкой.
Африка: Египет.
Северная Америка: США, Канада, Мексика.
Центральная Америка и страны Карибского бассейна: Гватемала (не подтверждено).
Южная Америка: Колумбия (не подтверждено). Сообщение из Чили - ошибка.
Океания: Новая Зеландия.
Вредоносность
Вредоносность ожога плодовых культур очень высока из-за быстрого его распространения. В сильно зараженных садах возбудитель заболевания может поражать от 20 до 50% насаждений, из которых до 10% полностью погибают [7]. В некоторых садах бактериальным ожогом поражается до 90% плодовых деревьев. Сильно поражаются болезнью декоративные растения, которые являются источником инфекции для культурных сортов.
Болезнь губит не только урожай, но и чрезвычайно опасна для деревьев, вызывая их преждевременную гибель. При благоприятных для возбудителя условиях во время цветения урожай значительно снижается, а иногда и полностью отсутствует. Особенно опасный период для заражения и интенсивного развития болезни - фаза цветения. На неустойчивых сортах патоген распространяется настолько быстро, что пораженные растения не могут быть спасены даже сильной и немедленной обрезкой и погибают через очень короткое время после первого обнаружения болезни.
Оценить экономический ущерб от ожога плодовых культур бывает достаточно сложно. Экономический ущерб выражается как в потерях урожая и гибели плодовых деревьев, так и в затратах на выкорчевку и уничтожение больных растений.
Так, в 1976 году в США, в штате Калифорния, по подсчетам экономистов, отмечались потери в 4,7 млн долларов. В 1991 году, при наличии идеальных для болезни условий, в юго-западном Мичигане потери составили 3,8 млн долларов. В 1998 году убытки от ожога плодовых в США составили 660 млн долларов. В регионе ЕОКЗР в последние годы убытки от ожога плодовых также возросли. Так, в Австрии потери в 2002 году составили 1,7 млн евро, в Испании в 1998-1999 гг. - 350 тыс. евро, в Чехии в 1999-2003 гг. - 54,7 тыс. евро, в Норвегии в 1986-2003 гг. - 1,5 млн евро и т.д. [8].
Вследствие сильного распространения ожога в зарубежных странах бывали случаи значительного сокращения площадей под насаждениями плодовых культур. Ни одна болезнь плодовых деревьев не имеет такого разрушительного действия, как ожог.
Потенциальная вредоносность бактериального ожога зависит от климата, вида, сорта, культуры, агротехники.
Вред, причиняемый бактериальным ожогом, сводится в основном к потери большого количества воды растениями. При этом наблюдается их угнетение, выражающееся в задержке роста и развития, уменьшении количества листьев и их размеров. При сильном заражении деревья перестают плодоносить, наблюдается усыхание сначала отдельных наиболее пораженных ветвей, а затем всего дерева.
У сильно зараженных деревьев часто снижается годовой прирост, листья уменьшаются в размере, снижается урожай, нередко деревья перестают плодоносить.
Несмотря на то, что бактериальный ожог выявлен на территории Казахстана совсем недавно, он уже нанес значительный ущерб крестьянским хозяйствам, занимающиеся плодоводством. Так, по данным территориальной инспекции Комитета государственной инспекции в АПК МСХ РК Алматинской области в 2014 году площадь пораженных бактериальным ожогом садов в Алматинской области составила 342 гектар.
Симптомы болезни
Первые признаки болезни обнаруживаются уже в первой декаде мая. Только, что распустившиеся цветы внезапно увядают, буреют и усыхают, но не опадают в течение всего сезона.
Почки не раскрываются, чернеют, усыхают и остаются на дереве. Бактерии быстро размножаются в цветках и через цветоножку переходят на молодые побеги, ветки и листья.
Поражение молодых побегов начинается с верхушки, и они постепенно усыхают, становятся коричневыми. Кончики их кручкообразно сгибаются и остаются в таком положении до конца вегетационного периода. Это является одним из признаков бактериального ожога и получило название «пастуший посох» (рисунок 1).

Рисунок 1 – «Пастуший посох»
Молодые листья начинают чернеть с края, постепенно усыхают и скручиваются. На более крупных листьях появляются небольшие красноватые некротические пятна между жилками, которые постепенно распространяются к периферии, увеличиваясь в размерах, покрывают полностью листовую поверхность и лист скручивается (рисунок 2).

Рисунок 2 – Симптомы некроза бактериального ожога на листьях яблони
Пораженные листья не опадают и остаются на дереве до конца вегетационного периода.
На незрелых яблоках появляются маслянистые красно-бурые пятна, которые постепенно охватывают всю поверхность плода, который приобретает коричневую окраску и постепенно мумифицируется.
Распространение болезни происходит сверху вниз. Симптомы болезни первоначально появляются на однолетних побегах, затем через паренхиму переходят к более старым ветвям и штамбам. На пораженных участках коры появляются водянистые пятна с нечеткой границей между здоровой и больной тканью. Эпидермис в пораженных местах отслаивается, образуя пузырьки. Кора растрескивается (рисунок 3).

Рисунок 3 – Растрескивание коры
На срезах коры в местах поражения отмечаются характерные для ожога мраморные рисунки с красновато коричневым оттенком (рисунок 4).

Рисунок 4 – Мраморность на срезе коры яблони
В местах трещин постепенно образуются клиновидные язвы – характерный признак бактериального ожога (рисунок 5).

Рисунок 5 – Клиновидные язвы на побегах
Прогрессирование болезни в весенний период слабо затрагивает поражение стеблей и скелетных веток. Симптомы в основном проявляются на соцветии, молодых листьях, черенках и молодых побегах (рисунок 6).

Рисунок 6 – Симптомы проявления болезни на молодых листья, плодах и завязях
При прогрессировании болезни в июне месяце уже отмечаются симптомы на скелетных ветках и штамбах. Более зрелые плоды и листья не поражаются бактериальным ожогом. Частое выпадение осадков в мае и июне усиливает развитие болезни в этот период. Повышение влажности воздуха способствует появлению на поверхности завязи, молодых побегах, плодах, скелетных ветках и коре капелек экссудата молочно-белого цвета, который постепенно приобретает янтарно-желтую окраску.
Наличие экссудата на пораженных органах дерева является главным признаком, отличающим бактериальный ожог от других болезней (рисунок 7).

Рисунок 7 – Выделение экссудата на плодах яблони
Характерные для бактериального ожога симптомы: поражение соцветий, согнутые побеги в виде «пастушьего посоха», выделение экссудата на пораженных органах, образование на коре клиновидных язв, а также мраморность. Симптомы на груше аналогичны (рисунок 8).

Рисунок 8 – Симптомы бактериального ожога на груше
Выделение в чистую культуру
Для установления этиологии заболевания в лабораторных условиях проводили бактериологические анализы отобранных в результате обследований образцов с целью изоляции возбудителя болезни в чистую культуру. Первоначально проводили тщательную поверхностную стерилизацию (рисунок 9). Плоды, стебли и кору обмакивали в спирте, затем трижды ополаскивали в стерильной воде; листья, цветки первоначально промывали в проточной воде, затем трижды в стерильной.

Рисунок 9 – Поверхностная стерилизация образцов
Затем их растирали в стерильной ступке (мацерация) с добавлением небольшого количества стерильной воды, делали серию разведении и высевали на питательную среду. Бактериологические анализы осуществлялись по общепринятым методикам, на картофельном агаре [9]. Чашки Петри помешали в термостат при температуре 26–27ºС через 2–3 суток на питательной среде появлялись колонии бактерий, затем проводили наблюдения за их ростом.
Морфологически свойства
Окончательный анализ выросших колоний проводили через 10-12 суток. За этот период у них четко оформляются культурально-морфологические признаки – размер, цвет, форма, профиль края, консистенция (рисунок 10). На основании этих особенностей отбирали колонии, которые по описанию в литературных источниках [2, 9, 10] соответствовали фитопатогенным бактериям Erwinia amylovora (Burrill.) Winslow et al. – возбудителю ожогаплодовых (таблица 1).
 А
А
|  б
б
|
 В
В
|  г
г
|
 Д
Д
|  е
е
|
Рисунок 10 – Типы колоний Erwinia amylovora
Таблица 1 – Культурально-морфологические особенности E.amylovora (2013–2014гг.).
| Диагностические признаки | Культурально-морфологические признаки |
| Типы колоний бактерий на картофельном агаре (КА) | Матовые, гладкие, слегка выпуклые, блестящие, центр уплотненный, края полупрозрачные (рисунок 10, а) Белые, конические, слизистые, центр и центральное кольцо уплотнены, края ровные, полупрозрачные (рисунок 10, б) Грязно-белые или кремовые, мелкие, блестящие, куполовидные, края ровные, полупрозрачные, растекающиеся (рисунок 10, в) Крупные, слизистые, выпуклые, центр уплотнен, края прозрачные растекающиеся (рисунок 10, г) Сероватые, мелкие (2-3 мм), выпуклые, центр уплотнен, края полупрозрачные, ровные (рисунок 10, д) Мелкие (2-3 мм), крупные (5-6 мм), плоские, матовые, блестящие, с шероховатой или складчатой поверхностью (рисунок 10, е) |
| Размер клеток | 0,5-0,8х1,2-1,8 мкм |
| Наличие/отсутствие спор | Отсутствуют |
| Окраска по Грамму | Граммотрицательные |
| Флюоресцирование на среде Кинга Б | Не флюоресцируют |
| Жгутикование | Перетрихальное (по всей поверхности) |
| Отношение к кислороду | Факультативные анаэробы |
Морфолого-биохимические свойства изолированных бактерий Erwinia amylovora изучали по общепринятым в бактериологии методикам [11]. Морфологические свойства исследовали путем микроскопирования – устанавливали форму и размер бактерий, расположение жгутиков, наличие капсул, спорообразование.
Одинаковые по морфологии колонии бактерии пересевали по 8 изолятов в чашки Петри, разделенных на 8 ячеек и присваивали им соответствующий номер. Затем отбирали по 2-3 изолята пересевали на косой агар для изучения их патогенных свойств на индикаторных растениях.
Установление патогенности
Проверку патогенных свойств изолированных бактерии проводили инфекционно-инфильтрационным методом Климента по реакции сверхчувствительности на индикаторном растений комнатной герани (Pelargonium zonala L.) (рисунок 11). Для этой цели использовали суточную культуру изолированных бактерий, концентрация инокулюма 109 кл/мл по стандарту мутности. Суспензию бактерий вводили стерильным шприцом в межклеточное пространство листа герани. В контроле использовали стерильную воду на том же растений индикаторе. Если суспензия содержит фитопатогенные бактерии, через 12-24 часов в месте инфильтрации образуется некротические пятна (в виде пергамента) (рисунок 12).

Рисунок 11 – Инокуляция комнатной герани бактериальной суспензией

Рисунок 12 – Реакция сверхчувствительности на герани
Это реакция сверхчувствительности индикаторного растения на патогенные виды бактерий. Непатогенные бактерии (сапрофиты) не вызывают такую реакцию (некроз), даже при введении высоких концентраций инокулюма.
Одновременно с постановкой реакции сверхчувствительности проверяли патогенность бактерий на молодых незрелых плодах груши по методу Уайта (рисунок 13).

Рисунок 13 – Инокуляция плодов груши по методу Уайта.
Инокулированные плоды груши помещали в эксикаторы, где поддерживали высокую влажность и выдерживали при t 25-26ºС (рисунок 14). Если через двое суток появляются темные некротические пятна и выделяется молочно-белый экссудат, следовательно выделенная бактерия действительно является бактерия Erwinia amylovora.

Рисунок 14 – Инокулированные плоды груши в эксикаторе.
Степень патогенности изолированных бактерий устанавливалась по срокам появления и интенсивности образования экссудата на незрелых плодах груши. Слабая степень образования экссудата обозначалась (+) (рисунок 15 а); средняя (++) (рисунок 15 б); сильная (+++) (рисунок 15 в).

Рисунок 15 а – слабая степень образования экссудата.

Рисунок 15 б – средняя степень образования экссудата.

Рисунок 15 в – сильная степень образования экссудата.
Таблица 2 – Результаты идентификации бактерий, возбудителей ожога, изолированных из различных культур Алматинской области и лесничеств ГНПП.
| Культура | Проанализи-ровано образцов | Выделено изолятов | Идентифицировано как, Er. amylovora | Сопутствующая микрофлора |
| Яблоня | ||||
| Груша | ||||
| Боярышник | - | |||
| Барбарис | ||||
| Слива | - |
Всего за период с 25 мая до 25 июля 2015 с территории Алматинской области было проанализировано 51 образцов различных культур. Из них выделено 130 изолятов, из которых идентифицировано как E.аmylovora – 51. Наибольшее количество изолятов было получено с яблони и груши, которые являются основными хозяевами бактериальной инфекции.
Фитоэкспертиза семян арбузов и дыни
Фитоэкспертиза семян предназначена для оценки зараженности семян возбудителями корневых гнилей (обыкновенной, фузариозной), а также сапротрофной и патогенной микрофлорой. Суть метода заключается в том, что семена проращивают в пластиковых контейнерах. При этом моделируют возникновение и развитие заболеваний на всходах растений за счет инфекции, связанной с семенами. Моделирование осуществляют путем выдерживания разных контейнеров с семенами в определенных температурных условиях. Выдерживание семян осуществляют в течение определенного для проращивания времени. После чего определяют интенсивность поражения всходов. Помимо пораженности всходов заболеваниями, определяют количество проросших и не проросших семян, интенсивность появления всходов. Затем делают вывод о необходимости протравливания семян.
Недостатком известного способа является то, что он учитывает лишь инфекционное начало, которое находится только на поверхности семян.
Целью фитоэкспертизы является повышение точности прогнозирования развития болезней в полевых условиях.
Фитоэкспертиза семян проводилась в рамках целевой программы за второй квартал 2015г. «Разработать научно-обоснованную систему защиты бахчевых культур (арбуз, дыня) от болезней и вредителей на юге Казахстана». За данный период проведена подготовка семян дыни и арбуза для полевых опытов, обработка их защитно-стимулирующими составами, отобранными ранее в результате лабораторных исследований.
Варианты опыта:
1. Превикур энерджи 4% + селест-топ 10% + КН-2 – 0,001%
2. Превикур энерджи 4% + престиж 10% + КН-2 – 0,001%
3. ТМТД в.с.к. 4% + селест-топ 10% + КН-2 – 0,001%
4. ТМТД в.с.к. 4% + престиж 10% + КН-2 – 0,0015%
5. ТМТД в.с.к. 4% + превикур-энерджи 4% + КН-2 – 0,001%
6. Контроль
Отбирались навески семян, которые были обработаны выше приведенными защитно-стимулирующими составами. Семена в контроле увлажняли стерильной водой. Семена смешивали с защитно-стимулирующими составами, тщательно перемешивали и оставляли на сутки. На следующий день производили посадку семян во влажные камеры, по 50 штук, в четырех повторностях (рисунок 16). Первый учет проводили на третий день, в дальнейшем – через каждые 2 дня. В каждой повторности считали количество проросших семян, интенсивность роста проростков по трехбалльной шкале (+, ++, +++) и зараженность семян патогенной и сапрофитной микрофлорой. Учеты проводили в течение 10 дней.

Рисунок 16 – Пример закладки семян во влажные камеры.
Энергия прорастания в контроле составила – дыни в пределах 60-78%, арбуза – 62-66%; лабораторная всхожесть дыни в пределах – 85-96%, арбуза –78-83 %.
Закладка полевого опыта дыни и арбуза производилась на стационаре ПК «Топшак», Сарыагашского района Южно-Казахстанской области, в 6 вариантах, в 4-х кратной повторности на каждой культуре. Размер делянок 100 м2.
На полевых опытах проводились учеты и наблюдения за всхожестью семян, развитием растений, распространением болезней и численностью вредителя. Во всех вариантах опыта с обработкой семян защитно-стимулирующими составами на данный период, не отмечено поражения корневыми гнилями и фузариозным увяданием. В то время как в контроле распространение болезней составило 5-8%, при степени развития 2 балла.
Повреждения подгрызающими совками, минером и паутинным клещом по вариантам опыта единичные и составляют от 1 до 3%.
Отмечено, что лучшие результаты по всхожести и развитию растений показали 2 и 3 варианты опыта (ТМТД в.с.к. 4% + селест-топ 10% + КН-2, ТМТД в.с.к. 4% + престиж 10% + КН-2).
Проверка эффективности препаратов против бактериального ожога плодовых
Проверка эффективности препаратов проводилась методом бумажных дисков. В первую очередь для этого необходимо приготовить чашки Петри с агаровой пленкой, засеянной тестовой культурой микроорганизма (так называемые «газоны»). В данном случае – энтомопатогенной бактерией Erwinia amylovora. Посевы «газоном» производят шпателем на питательный агар в чашке Петри. Для этого, приоткрыв левой рукой крышку, петлей или пипеткой наносят посевной материал на поверхность питательного агара. Затем проводят шпатель через пламя горелки, остужают его о внутреннюю сторону крышки и растирают материал по всей поверхности среды. После инкубации посева появляется равномерный сплошной рост бактерий.
Для проверки были использованы химические и биологические препараты, взятые в различных концентрациях.
Химические препараты:
CuSO4 в концентрациях 0,1%; 0,3%; 0,5%; 1%; 2%;
ZnSO4 в концентрациях 0,1%; 0,3%; 0,5%; 1%; 2%;
CuSO4 + ZnSO4 в концентрациях 0,1%; 0,3%; 0,5%; 1%; 2%;
Бардосская жидкость в концентрациях 0,1%; 0,3%; 0,5%; 1%; 2%;
Full Cobre в концентрациях 1% и 4%;
Synthesia в концентрациях 1% и 4%;
Controlfit Cu в концентрациях 1% и 4%;
Косайд в концентрациях 1% и 4%.
Биологические препараты:
Биостад в концентрациях 1% и 4%;
Азолен в концентрациях 1% и 4%;
Мультифаг в концентрациях 1% и 4%;
Бактериомицин в концентрациях 1% и 4%;
Казумин в концентрациях 1% и 4%;
Плантивакс в концентрациях 1% и 4%.
Разведение препаратов в 1% и 4% проводили следующим образом – для приготовления 1%- ной концентрации 1 мл. или грамм препарата разводился в 100 мл. воды и соответственно для получения 4%-ной концентрации 4 мл или грамма препарата разводили в 100 мл. воды (рисунки 17, 18, 19).

Рисунок 17 – Приготовление препаратов для проверки эффективности

Рисунок 18 – Приготовление препаратов

Рисунок 19 – Препараты, готовые к проведению испытаний (каждый в двухкратной повторности)
Спустя 24 ч определяют зоны ингибирования или стимулирования роста, проявляющиеся вокруг бумажных дисков (рисунки 20, 21). Отсутствие таких зон означает, что препарат не содержит метаболитов, влияющих на тест-микроорганизм.
Таблица 3 – Зона подавления препаратами роста бактерий
| Номер опыта | Препарат | Зона подавления роста бактерий, мм | |
| 1-ая повторность | 2-ая повторность | ||
| CuSO4 0,1% | - | 0,5 | |
| CuSO4 0,3% | |||
| CuSO4 0,5% | |||
| CuSO4 1% | |||
| CuSO4 2% | |||
| ZnSO4 0,1% | 0,5 | ||
| ZnSO4 0,3% | |||
| ZnSO4 0,5% | |||
| ZnSO4 1% | |||
| ZnSO4 2% | |||
| CuSO4 + ZnSO4 0,1% | 0,5 | - | |
| CuSO4 + ZnSO4 0,3% | |||
| CuSO4 + ZnSO4 0,5% | |||
| CuSO4 + ZnSO4 1% | |||
| CuSO4 + ZnSO4 2% | |||
| БЖ 0,1% | - | - | |
| БЖ 0,3% | |||
| БЖ 0,5% | |||
| БЖ 1% | |||
| БЖ 2% | |||
| Full Cobre 1% | |||
| Full Cobre 4% | |||
| Synthesia 1% | |||
| Synthesia 4% | |||
| Controlfit Cu 1% | |||
| Controlfit Cu 4% | |||
| Косайд 1% | |||
| Косайд 4% | |||
| Биостад 1% | |||
| Биостад 4% | |||
| Азолен 1% | |||
| Азолен 4% | |||
| Мультифаг 1% | - | ||
| Мультифаг 4% | |||
| Бактериомицин 1% | |||
| Бактериомицин 4% | |||
| Казумин 1% | |||
| Казумин 4% | |||
| Плантивакс 1% | |||
| Плантивакс 4% |

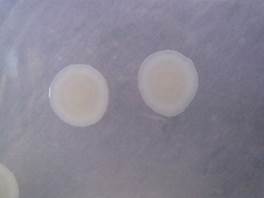
Рисунок 20 – Пример подавления препаратом бактериомицин (1%) зоны роста бактерий препаратом

Рисунок 21 – Пример подавления препаратом бактериомицин (4%) зоны роста бактерий
При этом необходимо учитывать, что одной проверки зачастую бывает недостаточно. Помимо данного метода проверки эффективности препаратов существуют и другие. Проведя лишь одно испытание, нельзя судить об эффективности того или иного препарата.
|
из
5.00
|
Обсуждение в статье: РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

