 |
Главная |
КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. РЕАКЦИОННАЯ СПОСОБНОСТЬ АМИНОВ
|
из
5.00
|
Кислотные и основные свойства органических соединений являются важными аспектами их реакционной способности. Перенос протона водорода наблюдается в ходе многих биохимических реакций.
Современные представления о природе кислот и оснований основаны на теории Бренстеда.
По Бренстеду, кислоты – это нейтральные молекулы и ионы, способные отдавать протоны водорода (доноры протонов). Основаниями являются нейтральные молекулы и ионы, способные присоединять протоны водорода (акцепторы протонов).
Кислотно-основное взаимодействие может быть представлено схемой:

 A-H + B A- + B+-H
A-H + B A- + B+-H
кислота основание сопряжённые
основание кислота
Кислота A-H, теряя протон, превращается в основание A-, которое называют сопряжённым основанием данной кислоты. Наоборот, основание B, принимая протон, превращается в сопряжённую кислоту B+-H.
В кислотно-основном равновесии существует важная закономерность: чем сильнее кислота, тем слабее сопряжённое с ней основание.
Понятие кислотности и основности взаимосвязаны: кислотные свойства проявляются только в присутствии оснований и наоборот.
Например, газообразный хлороводород не проявляет кислотных свойств, для этого необходимо присутствие основания:

 HCl + H2O Cl - + H3O+
HCl + H2O Cl - + H3O+
кислота основание сопряжённые
основание кислота
Некоторые соединения в зависимости от условий могут проявлять и кислотные, и основные свойства, т.е. понятия «кислота» и «основание» относительны. Например, в присутствии воды как основания уксусная кислота проявляет кислотные свойства, а в присутствии концентрированной серной кислоты – основные:

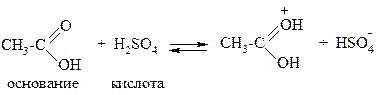
Так как в биохимических процессах растворителем обычно является вода, то дальше мы будем рассуждать о кислотно-основных свойствах соединений по отношению к воде.
Кислоты Бренстеда
 Сила кислот количественно выражается константой равновесия реакции (К), заключающейся в переносе протона водорода от кислоты к основанию – молекуле воды.
Сила кислот количественно выражается константой равновесия реакции (К), заключающейся в переносе протона водорода от кислоты к основанию – молекуле воды.
Используя значение константы равновесия этой реакции и учитывая, что концентрация воды практически постоянна, можно определить произведение K.[H2O], называемое константой кислотности (Ka) (от слова acid – кислота).
 |
Чем больше Ka, тем сильнее кислота. Но величины Ka очень малы (например, Ka уксусной кислоты 1,75. 10-5 ), пользоваться ими неудобно, поэтому введено понятие «показатель константы кислотности» (её отрицательный логарифм) - pKa. pKa=-lg Ka. Например, для уксусной кислоты pKa=4,75. Чем меньше величина pKa, тем сильнее кислота.
В зависимости природы кислотного центра (атома, отщепляющего протон водорода) различают следующие типы кислот:
- OH-кислоты (вода, спирты, фенолы, карбоновые кислоты);
- SH-кислоты (тиоспирты, тиофенолы, тиокислоты);
- NH-кислоты (аммиак, амины, амиды кислот, пиррол);
- CH-кислоты (углеводороды и их производные).
Сила кислот определяется стабильностью сопряжённых оснований – чем стабильнее сопряжённое основание (анион кислоты), тем сильнее кислота.
Стабильность сопряжённого основания определяется степенью делокализации заряда, которая зависит от следующих факторов: природа атома в кислотном центре, влияние радикала, степень сольватации.
Рассмотрим каждый из этих факторов.
Природа атома в кислотном центре. Для делокализации отрицательного заряда наибольшее значение имеют электроотрицательность атома и его поляризуемость.

 Чем выше электроотрицательность атома, получившего отрицательный заряд после отщепления протона, тем сильнее он этот отрицательный заряд удерживает и труднее предоставляет протону, а значит равновесие A-H А- + H+ смещается вправо.
Чем выше электроотрицательность атома, получившего отрицательный заряд после отщепления протона, тем сильнее он этот отрицательный заряд удерживает и труднее предоставляет протону, а значит равновесие A-H А- + H+ смещается вправо.
В периодах слева направо электроотрицательность возрастает. Поэтому OH-кислоты сильнее NH-кислот, а NH-кислоты сильнее CH-кислот (при прочих равных условиях).
Так как электроотрицательность атомов зависит от типа гибридизации, то среди CH-кислот при переходе от алканов к алкенам и далее к алкинам кислотность возрастает:
CH3-CH3 < CH2=CH2 < CH≡CH.
 Так, этан и этилен не реагируют с амидом натрия, а ацетилен – реагирует:
Так, этан и этилен не реагируют с амидом натрия, а ацетилен – реагирует:
В группах сверху вниз увеличивается поляризуемость. Это связано с тем, что увеличивается число энергетических уровней, т.е. объем электронных оболочек. Чем выше поляризуемость, тем более делокализован заряд, тем стабильнее анион, а значит, выше сила кислоты. Поэтому SH-кислоты сильнее, чем OH-кислоты. Например, спирты не реагируют со щелочами, а тиолы – реагируют:

Влияние радикала (заместителя). Кислотность органических соединений в значительной степени зависит от природы заместителя, связанного с реакционным центром. Особенно сильно повышает кислотные свойства наличие сопряженной системы в анионе.
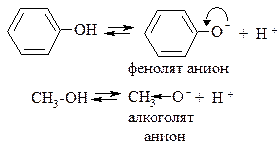 Сравним кислотные свойства спиртов и фенолов.
Сравним кислотные свойства спиртов и фенолов.
В случае фенолят-аниона (p,π-сопряженная система) степень делокализации заряда гораздо выше, поэтому фенолы более сильные OH-кислоты, чем спирты. Например, фенолы в отличие от спиртов реагируют с щелочами:
 |
Разницу в кислотных свойствах можно подтвердить и величинами pKa: для фенола pKa=10,00; для метанола pKa=16,00.
Фенолы – более сильные кислоты, чем спирты, но и они являются слабыми: фенол не вытесняет угольную кислоту из её солей, т.е. является более слабой кислотой, чем угольная.
Сравнивая кислотные свойства фенолов и карбоновых кислот, нужно отметить, что и фенолят-, и ацилат-анион являются p,π-сопряженными системами, но в ацилат-анионе наблюдается более полная делокализация отрицательного заряда за счёт двух электроотрицательных атомов кислорода:

В отличие от фенолов карбоновые кислоты взаимодействуют с гидрокарбонатом натрия:
 , т.е. они явля-
, т.е. они явля-
ются более сильными кислотами, чем угольная кислота.
Заместители в радикале также влияют на кислотные свойства. Если заместитель способствует делокализации отрицательного заряда в анионе (электроноакцепторный заместитель), то кислотность будет выше. И наоборот, электронодонорные заместители затрудняют делокализацию заряда и поэтому понижают кислотные свойства.
Сравним кислотные свойства следующих соединений: масляная кислота, α-хлормасляная и β-хлормасляные кислоты.
 |
Анион масляной кислоты стабилизируется только за счёт слабого индуктивного эффекта углеводородного радикала. Атом хлора проявляет сильный отрицательный индуктивный эффект, поэтому гораздо более сильно стабилизирует анион кислоты. Так как индуктивный эффект передается с затуханием, влияние хлора в α-положении проявляется сильнее. Итак, самой сильной является α-хлормасляная кислота, затем – β-хлормасляная и, наконец, самая слабая кислота – масляная. Это подтверждается и значениями pKa данных кислот.
В ароматическом ряду электроноакцепторные заместители также способствуют делокализации заряда, таким образом увеличивая кислотные свойства. Электронодонорные заместители оказывают обратное влияние.
 |
pKa=7,16 pKa=10,0 pKa=10,68
Суммируя все наши рассуждения, можно выстроить ряд убывания кислотных свойств OH-кислот:
карбоновые кислоты > угольная кислота > фенолы > спирты.
(Причем в каждой группе электронодонорные заместители понижают кислотность, а электроноакцепторные – повышают).
Основания Бренстеда
Основания, по Бренстеду, это нейтральные молекулы и ионы, способные присоединять протон водорода. Для образования ковалентной связи с протоном основания Бренстеда должны предоставлять или неподелённую электронную пару, или электроны π-связи. В соответствии с этим основания Бренстеда делятся на n-основания и π-основания.
n-Основания – это анионы или нейтральные молекулы, имеющие атом с неподелённой электронной парой. Их классифицируют по центрам основности следующим образом:

 - оксониевые основания: спирты R-ÖH, простые эфиры
- оксониевые основания: спирты R-ÖH, простые эфиры
R-Ö-R, сложные эфиры , альдегиды и кетоны
 |
 - аммониевые основания: амины , гетероциклические соединения, например, пиридин
- аммониевые основания: амины , гетероциклические соединения, например, пиридин
 |  |
- сульфониевые основания: тиоспирты , тиоэфиры .
π-Основания – соединения, имеющие π-связи, т.е. алкены, алкадиены, алкины, арены. Это очень слабые основания, т.к. протонируемые электронные пары несвободны. Например, этен проявляет π-основные свойства при образовании π-комплекса с протоном водорода:

Для количественной характеристики основности используют величину pKa сопряжённой с данным основанием кислоты (BH+). Эту величину обозначают pKBH+. Чем pKBH+ больше, тем сильнее основание.
Влияние природы атома в основном центре и связанных с ним заместителей на основность противоположно рассмотренному ранее их влиянию на кислотность:
 - с увеличением электроотрицательности атома основного центра основность уменьшается (атом труднее отдаёт свою неподелённую электронную пару для присоединения протона), т.е. аммониевые основания сильнее оксониевых. Так, этанол способен взаимодействовать только с концентрированными минеральными кислотами:
- с увеличением электроотрицательности атома основного центра основность уменьшается (атом труднее отдаёт свою неподелённую электронную пару для присоединения протона), т.е. аммониевые основания сильнее оксониевых. Так, этанол способен взаимодействовать только с концентрированными минеральными кислотами:
,
 а этиламин проявляет основные свойства даже при взаимодействии с водой:
а этиламин проявляет основные свойства даже при взаимодействии с водой:
.
- с увеличением поляризуемости атома основного центра основность уменьшается, т.е. оксониевые основания сильнее сульфониевых;
- электронодонорные заместители повышают основность, а электроноакцепторные – понижают (чем выше электронная плотность на основном центре, тем легче он предоставит свою электронную пару протону). Так, в ряду п-нитроанилин, анилин,
п-толуидин основность повышается: нитро-группа является электроноакцепторным заместителем, а метильная группа – электронодонорным. Это подтверждают и значения pKBH+.
 |
pKBH+=1,00 pKBH+=4,60 pKBH+=5,10
Итак, самыми сильными основаниями являются аммониевые. Основность различных типов аминов мы обсудим, рассматривая химические свойства аминов в целом.
АМИНЫ
Амины – это производные аммиака, в молекуле которого один, два или три атома водорода замещены углеводородными радикалами. Отсюда первый тип классификации аминов: по количеству радикалов амины подразделяют на первичные, вторичные и третичные.
 |
Другой вид классификации аминов – по природе радикалов. Амины подразделяют на алифатические и ароматические. Например, приведенные выше амины являются алифатическими, а анилин (аминобензол) – ароматическим:
 |
Для названия аминов применяют радикало-функциональную и заместительную номенклатуру IUPAC. По радикало-функциональной номенклатуре называют радикал или радикалы, если их несколько (в алфавитном порядке), и добавляют слово «амин», например, метиламин, метилэтиламин, диметиламин и т.д. Те амины, которые нельзя назвать по радикало-функциональной номенклатуре (сложные радикалы), называют по заместительной номенклатуре, например:

Ароматические амины обычно рассматривают как производные анилина, например:
 |
За счёт неподелённой электронной пары азота амины проявляют основные и нуклеофильные свойства.
Сравним основные свойства различных групп аминов.
Алифатические амины являются более сильными основаниями, чем ароматические. Это связано с тем, что неподелённая электронная пара азота в ароматических аминах участвует в p,π-сопряжении и менее доступна для атаки протона водорода. В алифатических же аминах электронная плотность на атоме азота аминогруппы повышена за счёт электронодонорного влияния алкильных групп:
 |
 Алифатические амины взаимодействуют с минеральными кислотами, карбоновыми кислотами и даже с водой (очень слабой кислотой):
Алифатические амины взаимодействуют с минеральными кислотами, карбоновыми кислотами и даже с водой (очень слабой кислотой):
 | |||
 |
 Ароматические амины как слабые основания взаимодействуют с минеральными кислотами:
Ароматические амины как слабые основания взаимодействуют с минеральными кислотами:
Заместители в ароматическом кольце влияют на основные свойства аминов: электронодонорные заместители повышают основные свойства, а электроноакцепторные – понижают (см. стр.71).
Сравним основные свойства различных типов алифатических аминов – первичных, вторичных и третичных, например, метиламина, диметиламина и триметиламина.
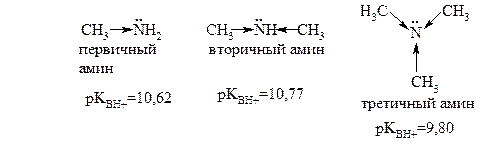 |
Чем выше электронная плотность на атоме азота, тем выше основные свойства амина. Каждая метильная группа смещает электронную плотность к атому азота, поэтому можно было бы предположить, что самым сильным основанием является третичный амин. Однако, сравнивая значения pKBH+, можно увидеть, что это не так: самым сильным основанием является вторичный амин. Этот факт можно объяснить с позиций пространственной доступности неподелённой электронной пары азота: в триметиламине три крупных заместителя «прикрывают» её. Таким образом, ряд убывания основности алифатических аминов:
вторичные > первичные > третичные.
За счет неподелённой электронной пары азота амины проявляют также нуклеофильные свойства. Амины являются нуклеофилами, например, в реакциях алкилирования и ацилирования.
Алкилирование – это введение в молекулу алкила (метил, этил, пропил и т.п.). В качестве алкилирующих реагентов обычно используют алкилгалогениды (этилхлорид, метилбромид, например). Так, в реакции этиламина с метилхлоридом образуется метилэтиламин:
 |
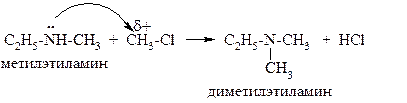 Это реакция нуклеофильного замещения. Она позволяет получить вторичный амин из первичного и третичный – из вторичного.
Это реакция нуклеофильного замещения. Она позволяет получить вторичный амин из первичного и третичный – из вторичного.
Ароматические амины также вступают в реакции алкилирования, но менее активно, т.к. их нуклеофильные свойства понижены (неподелённая электронная пара, отвечающая за них, участвует в p,π-сопряжении).
 |
Ацилированием называют введение в молекулу ацила – остатка карбоновой кислоты (например, ацетил – это остаток уксусной кислоты, пропионил – пропионовой). Для ацилирования аминов обычно используют ангидриды соответствующих кислот.
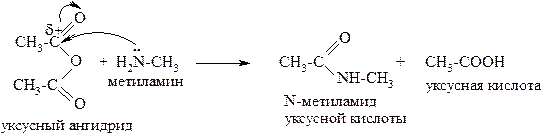 |
Подробнее мы будем рассматривать эти реакции, изучая тему «Карбоновые кислоты и их функциональные производные».
Для ароматических аминов характерны также реакции, протекающие за счёт ароматического кольца – реакции электрофильного замещения. Ранее мы уже рассматривали влияние аминогруппы на ход реакций SE (см. стр.44,45): аминогруппа, являясь электронодонорным заместителем (+MNH2 >> -INH2), облегчает эти реакции в сравнении с бензолом и является орто-, пара-ориентантом. Например, бромирование анилина бромной водой приводит к образованию белого осадка 2,4,6-триброманилина:
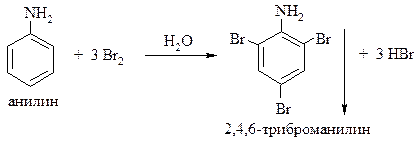 |
Эту реакцию используют для качественного обнаружения анилина.
|
из
5.00
|
Обсуждение в статье: КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. РЕАКЦИОННАЯ СПОСОБНОСТЬ АМИНОВ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

