 |
Главная |
В структуре всех восстанавливающих дисахаридов есть свободный полуацетальный гидроксил
|
из
5.00
|
Наличие свободного полуацетального гидроксила ведет к возможности цикло-оксо-таутомерии, следовательно, свежеприготовленные растворы восстанавливающих дисахаридов мутаротируют. Например, мальтоза существует в растворе в виде α- и β-циклических таутомеров, а также в открытой (оксо-) таутомерной форме:
 |
 Из-за наличия альдегидной группы в оксо-форме восстанавливающие дисахариды обладают восстанавливающими свойствами, они окисляются слабыми окислителями (аммиачный раствор оксида серебра, гидроксид меди (II)) в щелочной среде. Так же, как моносахариды, дисахариды неустойчивы при нагревании в щелочной среде, поэтому в реакции образуются различные продукты окисления:
Из-за наличия альдегидной группы в оксо-форме восстанавливающие дисахариды обладают восстанавливающими свойствами, они окисляются слабыми окислителями (аммиачный раствор оксида серебра, гидроксид меди (II)) в щелочной среде. Так же, как моносахариды, дисахариды неустойчивы при нагревании в щелочной среде, поэтому в реакции образуются различные продукты окисления:
При окислении слабыми окислителями в слабокислой или нейтральной среде (например, бромной водой) образуются бионовые кислоты (мальтобионовая, лактобионовая и т.п.):
 |
Полуацетальный гидроксил восстанавливающих дисахаридов участвует в образовании гликозидов:
 |
Все дисахариды являются O-гликозидами, поэтому для них характерны реакции гидролиза в кислой среде:
 |
Как и моносахариды, восстанавливающие дисахариды алкилируются и ацилируются по всем гидроксильным группам. Например, при исчерпывающем метилировании мальтозы образуется продукт октаметилмальтоза, в структуре которой присутствуют как O-гликозидные, так и простые эфирные связи:
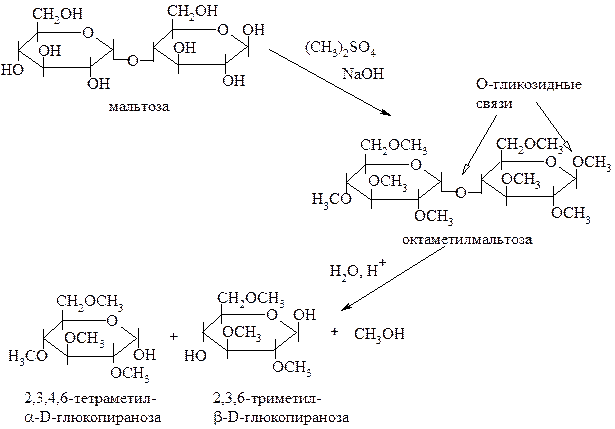 |
Кислотному гидролизу подвергаются только гликозидные связи.
В реакциях ацилирования также участвуют и спиртовые, и полуацетальные гидроксильные группы. Все вновь образующиеся связи – сложноэфирные, связь между двумя моносахаридными остатками – O-гликозидная. Сложные эфиры подвергаются гидролизу как в кислой, так и в щелочной среде, гликозиды – только в кислой. Поэтому в зависимости от условий гидролиза ацилированного дисахарида можно получить различные продукты:
 |

К невосстанавливающим дисахаридам относится сахароза, молекула которой построена из остатков α-D-глюкопиранозы и β-D-фруктофуранозы, связанных 1,2-гликозидной связью (α-D-глюкопиранозил-1,2-β-D-фруктофуранозид):
 |
Гликозидная связь образовалась за счет взаимодействия двух полуацетальных гидроксилов, свободная полуацетальная группа отсутствует, следовательно, невозможна цикло-цепная таутомерия. Отсюда отсутствие восстанавливающих свойств у сахарозы.
Как гликозид сахароза гидролизуется в кислой среде до глюкозы и фруктозы. Образующуюся смесь моносахаридов называют искусственным медом, или инвертным сахаром («инвер-
сия» – обращение). Это название появилось потому, что сахароза обладает правым вращением, а образовавшаяся смесь моносахаридов – левым, т.к. фруктоза значительно сильнее вращает плоскость поляризованного луча влево, чем глюкоза – вправо.
ПОЛИСАХАРИДЫ
Полисахариды (полиозы) – высокомолекулярные соединения. Их молекулы состоят из нескольких сотен моносахаридных звеньев, связанных O-гликозидными связями, образующих разветвленные или неразветвленные цепи. По химической природе все полисахариды являются полигликозидами. В полисахаридах растительного происхождения чаще всего встречаются 1,4- и 1,6-гликозидные связи. В полисахаридах животного и бактериального происхождения – также 1,2- и 1,3-гликозидные связи.
На концах цепей имеются свободные полуацетальные гидроксильные группы, но восстанавливающие свойства практически не проявляются, т.к. доля восстанавливающего фрагмента относительно всей молекулы очень мала.
Полисахариды, состоящие из остатков одного моносахарида, называются гомополисахаридами, из остатков разных моносахаридов – гетерополисахаридами.
Гомополисахариды. Гомополисахариды, построенные из остатков пентоз, называются пентозанами, из остатков гексоз – гексозанами. Большинство природных гомополисахаридов – гексозаны. К ним относятся крахмал, целлюлоза, гликоген, декстраны.
Крахмал является основным источником резервной энергии в растениях. Крахмал на 10-20% состоит из растворимой в горячей воде амилозы и на 80-90% – из нерастворимого амилопектина.
При постепенном кислотном или ферментативном гидролизе амилоза и амилопектин расщепляются до декстринов (смесь полисахаридов с меньшей молекулярной массой), затем до мальтозы и глюкозы:
 |
Мономером обеих фракций крахмала является D-глюкоза. Различия в строении амилозы и амилопектина связаны с характером гликозидных связей.
 В амилозе D-глюкопиранозные остатки связаны
В амилозе D-глюкопиранозные остатки связаны
α-1,4-гликозидными связями. Цепь амилозы неразветвленная, включает до 1000 глюкозных остатков (молекулярная масса до 160 000).
По данным рентгеноструктурного анализа, молекула амилозы свернута в спираль (рис. 3), на каждый виток которой приходится 6 моносахаридных звеньев. Возможность такой пространственной структуры связана с конфигурацией аномерного углерода у α-D-глюкопиранозы – полуацетальный гидроксил находится в аксиальном положении (см. стр. 162).

Рис. 3. Фрагмент спирали амилозы.
Во внутреннюю полость этой спирали могут входить подходящие по размеру молекулы, например, молекулы иода, образуя комплексы, так называемые соединения включения. Комплекс амилозы с иодом имеет синюю окраску. Эта реакция используется и для открытия крахмала, и для обнаружения иода.
Амилопектин имеет разветвленное строение. В цепи
D-глюкопиранозные остатки связаны α-1,4-гликозидными связями, а в точках ветвления – α-1,6-гликозидными связями. Между точками ветвления расположены 20-25 моносахаридных остатков. Молекула амилопектина состоит из нескольких тысяч остатков D-глюкозы (молекулярная масса – 1-6 млн.).

В связи с наличием разветвлений молекула амилопектина не способна принимать форму спирали и связывает иод в незначительных количествах.
Гидролиз крахмала в пищеварительном тракте происходит с участием фермента амилазы, расщепляющего α-1,4- и
α-1,6-гликозидные связи. Конечными продуктами гидролиза являются мальтоза и глюкоза.
В животных организмах функцию запасного питательного вещества выполняет гликоген (животный крахмал). Строение гликогена сходно со строением амилопектина, но его молекула еще более разветвлена. Между точками ветвления находится
10-12 глюкозных остатков (молекулярная масса гликогена может достигать многих млн.). Сильная разветвленность цепей гликогена способствует атаке его ферментами сразу со многих концов. Это приводит к чрезвычайно высокой скорости расщепления полисахарида и, следовательно, к почти мгновенной мобилизации заключенных в гликогене энергетических запасов. Наиболее богаты гликогеном печень и мышцы.
 Декстраны – полисахариды бактериального происхождения. Они построены из остатков α-D-глюкопиранозы. Молекулы декстранов сильно разветвлены. Основной тип связи –
Декстраны – полисахариды бактериального происхождения. Они построены из остатков α-D-глюкопиранозы. Молекулы декстранов сильно разветвлены. Основной тип связи –
α-1,6-гликозидная, в местах ветвления – α-1,3 и α-1,4:
Молекулярная масса декстранов достигает нескольких млн. Они плохо растворимы в воде. Путем частичного гидролиза получают так называемые «клинические декстраны» с молекулярной массой 50-100 тыс. Их используют в качестве заменителя плазмы крови (препарат «Полиглюкин»).
Наиболее широко распространенный растительный гомополисахарид – целлюлоза (клетчатка). Молекулы целлюлозы обладают большой механической прочностью, поэтому выполняют роль опорного материала растений.
Молекула целлюлозы – длинная линейная цепь, состоящая из остатков β-D-глюкопиранозы, тип связи между моносахаридными остатками – β-1,4-гликозидная. Молекулярная масса целлюлозы от 400 000 до 2 млн.
 |
β-Конфигурация аномерного атома углерода приводит к линейному строению молекулы (β-полуацетальный гидроксил занимает экваториальное положение) (рис. 4).
 |
Внутри цепи и между параллельными цепями образуются
Рис. 4. Строение фрагмента молекулы целлюлозы.
Внутри цепи и между параллельными цепями образуются водородные связи, что обеспечивает высокую механическую прочность, волокнистость, нерастворимость целлюлозы в воде.
Как O-гликозид целлюлоза способна к кислотному гидролизу с образованием глюкозы.
В человеческом организме нет фермента, расщепляющего
β-гликозидные связи целлюлозы, поэтому она не усваивается организмом, но является необходимым компонентом пищи, т.к. улучшает пищеварение.
Целлюлоза является важным сырьем в бумажной и текстильной промышленности. Большое практическое применение находят эфиры целлюлозы – ацетаты (искусственный шелк), ксантогенаты (вискоза, целлофан), нитраты (смесь моно- и динитратов – коллоксилин в виде спирто-эфирного раствора используется для заклеивания мелких ранок и ссадин; тринитрат является взрывчатым веществом).
 В животных организмах опорные и механические функции выполняет хитин (роговые оболочки насекомых, панцири ракообразных). Хитин построен из остатков N-ацетилглюкозамина, связанных β-1,4-гликозидными связями:
В животных организмах опорные и механические функции выполняет хитин (роговые оболочки насекомых, панцири ракообразных). Хитин построен из остатков N-ацетилглюкозамина, связанных β-1,4-гликозидными связями:
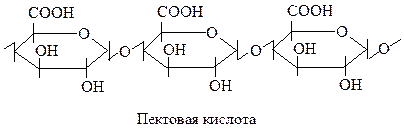 К гомополисахаридам относятся также пектины. В основе их структуры лежит пектовая (полигалактуроновая) кислота. Остатки галактуроновой кислоты связаны α-1,4-гликозидными связями:
К гомополисахаридам относятся также пектины. В основе их структуры лежит пектовая (полигалактуроновая) кислота. Остатки галактуроновой кислоты связаны α-1,4-гликозидными связями:
В состав пектинов полигалактуроновая кислота может входить в виде сложных эфиров по карбоксильной группе и солей.
Пектины содержатся в овощах и плодах, для них характерно желеобразование под действием органических кислот, что используется в пищевой промышленности (желе, мармелад). Пектины обладают противоязвенным действием (препарат «Плантаглюцид» содержит пектины подорожника).
Гетерополисахариды. К гетерополисахаридам принадлежат полисахариды соединительной ткани – хондроитинсульфаты (содержатся в коже, хрящах), гиалуроновая кислота (в стекловидном теле, суставной жидкости, хрящах) гепарин (в печени).
В строении гетерополисахаридов есть общие черты – их молекулы линейны и состоят из повторяющихся дисахаридных фрагментов, в состав которых входят остатки уроновых кислот (глюкуроновая, галактуроновая) и N-ацетилгексозаминов
(N-ацетилглюкозамин, N-ацетилгалактозамин).
 Хондроитинсульфаты состоят из дисахаридных остатков
Хондроитинсульфаты состоят из дисахаридных остатков
N-ацетилированного хондрозина, соединенных β-1,4-глико-
зидными связями. Сам хондрозин состоит из остатков
D-глюкуроновой кислоты и D-галактозамина, связанных
β-1,3-гликозидной связью:
Хондроитинсульфаты являются эфирами серной кислоты. Сульфатная группа присутствует в 4-м или 6-м положении
N-ацетилгалактозамина. Соответственно различают хондроитин-4-сульфат и хондроитин-6-сульфат.
 |
Хондроитинсульфатные цепи соединены O-гликозидными связями с гидроксильными группами аминокислотных остатков белков.
Гиалуроновая кислота построена из дисахаридных фрагментов, связанных β-1,4-гликозидными связями. Дисахаридный фрагмент состоит из остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, связанных β-1,3-гликозидной связью.
 |
Гиалуроновая кислота имеет высокую молекулярную массу (2-7 млн.). Ее растворы обладают высокой вязкостью, с чем связывают ее функции по обеспечению непроницаемости соединительной ткани для патогенных микроорганизмов.
Хондроитинсульфаты и гиалуроновая кислота содержатся в организме в связанном виде с полипептидными цепями. Углеводсодержащие смешанные биополимеры составляют основу клеток и жидкостей животных организмов. Если в молекуле биополимера преобладает полисахаридная часть, его относят к протеогликанам, если полипептидная часть – к гликопротеинам.
ПРИРОДНЫЕ α-АМИНОКИСЛОТЫ. ПЕПТИДЫ, БЕЛКИ
α-Аминокислоты являются мономерными единицами биополимеров – пептидов и белков. Белки – основа всего живого. Функции белков в природе многообразны. Это ферменты и гормоны, выполняющие регуляторную функцию, структурные белки (кератин, коллаген), транспортные (гемоглобин), защитные (иммуноглобулины). Некоторые аминокислоты используются как лекарственные средства, например, глутаминовая кислота – при заболеваниях ЦНС, метионин – для лечения заболеваний печени, цистеин – как радиопротектор, а также в глазной практике.
В природе в свободном и связанном виде обнаружены сотни аминокислот, 20-25 из них постоянно встречаются во всех белках.
Строение и классификация природных α-аминокислот
 Общая формула α-аминокислот (исключение – пролин и оксипролин):
Общая формула α-аминокислот (исключение – пролин и оксипролин):
В основном используют тривиальные названия α-аминокислот. В биохимии часто пользуются сокращенными трехбуквенными названиями.
Согласно общей формуле, аминокислоты отличаются лишь строением радикала, в соответствии с чем они классифицируются на алифатические, ароматические и гетероциклические. Среди алифатических аминокислот в зависимости от наличия в радикале функциональной группы выделяют подгруппы гидрокси- и серосодержащих аминокислот.
Примеры алифатических аминокислот:
 | ||||||||||||||||||||||||
 | ||||||||||||||||||||||||
 |  | |||||||||||||||||||||||
 | ||||||||||||||||||||||||
 | ||||||||||||||||||||||||
 | ||||||||||||||||||||||||
 |  | |||||||||||||||||||||||
 |  | |||||||||||||||||||||||
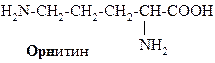 | ||||||||||||||||||||||||
 | ||||||||||||||||||||||||
 | ||||||||||||||||||||||||
Примерами ароматических аминокислот являются фенилаланин и тирозин:
 |
К гетероциклическим аминокислотам относятся:
 | |||
 |
В зависимости от соотношения количества карбоксильных и аминогрупп в молекулах различают нейтральные (моноаминомонокарбоновые) – глицин, аланин и др., кислые (моноаминодикарбоновые) – аспарагиновая, глютаминовая кислоты, основные (диаминомонокарбоновые) аминокислоты – лизин, орнитин, аргинин.
Природа радикала в молекулах аминокислот значительно влияет на свойства белков. Например, наличие полярных групп
(-SH, NH2, -OH, COOH, фенольного гидроксила) увеличивает растворимость белков. Кроме того, эти группы принимают участие в образовании связей, формирующих пространственную структуру белка. За счет карбоксильной и аминогруппы многие ферменты обеспечивают кислотный или основный катализ ряда биохимических процессов.
Большинство α-аминокислот синтезируется в организме, но некоторые организм не способен синтезировать, они должны поступать с пищей. Эти аминокислоты называют незаменимыми, в норме их восемь: валин, лейцин, изолейцин, треонин, метилнин, фенилаланин, триптофан, лизин. При некоторых заболеваниях незаменимых аминокислот больше. Так, фенилкетонурия (пировиноградная олигофрения) представляет собой врожденное нарушение обмена веществ, каким-то образом связанное с некоторыми умственными расстройствами. Люди, страдающие этим заболеванием, нуждаются еще в одной незаменимой для них аминокислоте – тирозине, т.к. в отличие от здоровых людей их организм не способен превращать фенилаланин в тирозин.
Стереоизомерия α-аминокислот
Все α-аминокислоты, за исключением глицина, имеют в своей структуре хотя бы один хиральный центр, значит, для них характерна оптическая изомерия. Например, аланин существует в виде пары энантиомеров:
 |
Относительная конфигурация стереоизомеров определяется в сравнении с конфигурационным стандартом – стереоизомерами глицеринового альдегида.
Все α-аминокислоты, участвующие в построении молекул белков животных и человека, имеют L-конфигурацию. D-ами-
нокислоты встречаются в некоторых грибах и микроорганизмах.
 α-Аминокислоты представляют собой кристаллические вещества с высокой температурой плавления, растворимые в воде, но не растворимые в неполярных растворителях. Эти свойства результат того, что и в кристаллическом состоянии, и в водных растворах аминокислоты существуют в виде биполярных ионов (цвиттер-ионов). Возможность образования биполярных ионов связана с амфотерностью аминокислот, в молекулах которых присутствуют и кислотные COOH-группы, и основные
α-Аминокислоты представляют собой кристаллические вещества с высокой температурой плавления, растворимые в воде, но не растворимые в неполярных растворителях. Эти свойства результат того, что и в кристаллическом состоянии, и в водных растворах аминокислоты существуют в виде биполярных ионов (цвиттер-ионов). Возможность образования биполярных ионов связана с амфотерностью аминокислот, в молекулах которых присутствуют и кислотные COOH-группы, и основные
NH2-группы. Близость этих групп у α-аминокислот облегчает переход протона H+:
 Практически α-аминокислоты в водном растворе существуют в виде равновесной смеси из цвиттер-ионов, катионной и анионной форм:
Практически α-аминокислоты в водном растворе существуют в виде равновесной смеси из цвиттер-ионов, катионной и анионной форм:
Положение такого равновесия существенно зависит от pH среды: в сильнокислой среде (pH=1-2) преобладает катионная форма, в сильнощелочной (pH=13-14) – анионная.
Если поместить раствор аминокислоты в электрическое поле, то в кислых растворах она будет мигрировать к катоду, а в щелочных – к аноду. При некотором значении pH, характерном для данной аминокислоты, она не будет перемещаться в электрическом поле. При этом значении pH, называемом изоэлектрической точкой (ИЭТ, pI), аминокислота существует в виде биполярного иона и в целом электронейтральна. Итак, изоэлектрическая точка аминокислоты – это то значение pH раствора, при котором большинство молекул данной аминокислоты существуют в виде биполярных ионов, а концентрации анионной и катионной форм минимальны и равны.Изоэлектрическая точка зависит от соотношения кислотных и основных групп в молекуле: pI кислых аминокислот имеет значение <7, pI основных аминокислот >7.
При пропускании электрического тока через раствор, содержащий смесь аминокислот, каждая из них будет двигаться к катоду или аноду со скоростью, зависящей от природы аминокислоты и pH среды. Это явление используют для разделения и анализа смеси аминокислот методом электрофореза.
Химические свойства
 Являясь амфотерными соединениями, аминокислоты реагируют и с кислотами, и с щелочами:
Являясь амфотерными соединениями, аминокислоты реагируют и с кислотами, и с щелочами:
Характерной особенностью α-аминокислот является способность образовывать комплексные соли с ионами тяжелых металлов:
 |
Медные соли аминокислот нерастворимы в воде, имеют интенсивное синее окрашивание. Эта реакция используется для обнаружения α-аминокислот.
 Другой общей качественной реакцией α-аминокислот является их взаимодействие с нингидрином с образованием продукта сине-фиолетового цвета:
Другой общей качественной реакцией α-аминокислот является их взаимодействие с нингидрином с образованием продукта сине-фиолетового цвета:
 Как карбоновые кислоты, α-аминокислоты образуют сложные эфиры при взаимодействии со спиртами и хлорангидриды при взаимодействии с тионилхлоридом или хлоридами фосфора:
Как карбоновые кислоты, α-аминокислоты образуют сложные эфиры при взаимодействии со спиртами и хлорангидриды при взаимодействии с тионилхлоридом или хлоридами фосфора:
Сложные эфиры α-аминокислот летучи, они имеют сравнительно низкие температуры кипения. Это их свойство используется для разделения смеси аминокислот в белковых гидролизатах (эфирный метод Фишера). С этой целью аминокислоты сначала этерифицируют, а потом подвергают перегонке.
За счет аминогруппы α-аминокислоты подвергаются реакциям ацилирования и алкилирования, взаимодействуют с оксосоединениями. Так, при ацилировании аминокислоты уксусным ангидридом образуется N-ацетильное производное. При взаимодействии с формальдегидом образуется продукт нуклеофильного присоединения – N-метилольное производное, которое достаточно устойчиво (с другими оксосоединениями протекает реакция нуклеофильного присоединения-отщепления).
 |
Реакцию ацилирования раньше использовали для защиты аминогруппы в синтезе пептидов. Реакция с формальдегидом лежит в основе метода количественного анализа аминокислот (метод формольного титрования, метод Зеренсена). Сущность метода формольного титрования заключается в следующем: до взаимодействия с формальдегидом растворы большинства аминокислот имеют реакцию, близкую к нейтральной; N-метилольное производное проявляет кислотные свойства и может быть оттитровано раствором щелочи с известной концентрацией.
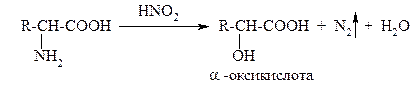 Как первичные алифатические амины α-аминокислоты подвергаются действию азотистой кислоты с образованием соответствующих α-оксикислот и выделением азота:
Как первичные алифатические амины α-аминокислоты подвергаются действию азотистой кислоты с образованием соответствующих α-оксикислот и выделением азота:
Эту реакцию называют реакцией дезаминирования in vitro. Ее используют и как качественную реакцию для доказательства наличия первичной алифатической аминогруппы (наблюдают выделение пузырьков газа), и для количественного анализа (метод Ван-Слайка) – по объему выделившегося азота рассчитывают количество аминокислоты, вступившей в реакцию.
Специфическим свойством α-аминокислот является их способность к декарбоксилированию при нагревании в присутствии гидроксида бария:
 |
Рассмотренные выше реакции характерны для всех α-аминокислот. Существуют также реакции на определенные группы аминокислот.
Для обнаружения ароматических аминокислот используют так называемую ксантопротеиновую реакцию. При нагревании этих аминокислот (или белков, в структуре которых присутствуют их остатки) с концентрированной азотной кислотой образуются продукты нитрования желтого цвета, которые в щелочной среде приобретают оранжевую окраску:

 Серосодержащие аминокислоты (цистеин, цистин, метионин) обнаруживают по реакции с ацетатом свинца (реакция Фоля).
Серосодержащие аминокислоты (цистеин, цистин, метионин) обнаруживают по реакции с ацетатом свинца (реакция Фоля).
При нагревании с щелочью серосодержащие аминокислоты разлагаются, одним из продуктов разложения является сульфид натрия. При дальнейшем добавлении ацетата свинца образуется осадок сульфида свинца серо-черного цвета.
Реакции α-аминокислот in vivo
Аминокислоты не накапливаются в клетке: как правило, их избыток разрушается при помощи реакций, которые снабжают живую систему энергией. Аминокислоты принимают участие в метаболических процессах, в результате которых в клетке синтезируются необходимые ей соединения. Основные реакции, за счет которых осуществляется превращение аминокислот в клетке, – это декарбоксилирование, дезаминирование, переаминирование. Эти реакции катализируются соответствующими ферментами.
В результате реакций декарбоксилирования образуются биогенные амины.
 |
Реакции дезаминирования могут осуществляться как по окислительному, так и по неокислительному пути.
Неокислительное дезаминирование встречается в основном у растений и грибов. Так, например, с участием фермента аспартазы протекает дезаминирование аспарагиновой кислоты с образованием транс-бутендиовой (фумаровой) кислоты:
 |
Окислительное дезаминирование осуществляется через образование промежуточной иминокислоты, которая затем подвергается гидролизу:

Переаминирование α-аминокислот сводится к взаимопревращению их аминогрупп и карбонильных групп α-кетокислот под действием ферментов трансаминаз (аминотрансфераз). Это основной путь биосинтеза α-аминокислот из α-кетокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетке в достаточном количестве, а ее акцептором – кетокислота. Например, таким образом, из аспарагиновой кислоты в клетке может быть синтезирован аланин или глютаминовая кислота:
 | |||
 |
Реакция переаминирования является связующим звеном между процессами метаболизма белков (аминокислоты) и углеводов (кетокислоты).
ПЕПТИДЫ И БЕЛКИ
Пептиды и белки – соединения, построенные из остатков α-аминокислот. Деление между ними условное: принято считать, что пептиды построены из остатков менее 100 аминокислот, белки – более 100 аминокислот.
Можно рассматривать полипептидную цепь как продукт поликонденсации α-аминокислот, а пептидную связь – как амидную, т.е. пептиды и белки являются полиамидами. Схематично образование трипептида можно показать следующим образом:

Пептидная цепь имеет неразветвленное строение и состоит из чередующихся пептидных (амидных) групп и CH-групп с соответствующими радикалами. Принято записывать структуру пептида, начиная со свободной аминогруппы (N-конца молекулы) и заканчивая свободной карбоксильной группой (C-конец).
 Названия пептидов строятся путем последовательного перечисления аминокислотных остатков, начиная с N-конца. Названия аминокислот, вступивших в образование пептидной связи своей карбоксильной группой, заканчиваются суффиксом «-ил», например:
Названия пептидов строятся путем последовательного перечисления аминокислотных остатков, начиная с N-конца. Названия аминокислот, вступивших в образование пептидной связи своей карбоксильной группой, заканчиваются суффиксом «-ил», например:
Амидная связь между двумя α-аминокислотными остатками называется пептидной связью. Атомы углерода, азота и кислорода пептидной связи находятся в sp2-гибридизации, все 4 атома CONH-группы расположены в одной плоскости под углом 120о.
 Неподеленная пара электронов азота вступает в p,π-сопряжение с электронным облаком π-связи карбонильной группы, вследствие чего связь C=O несколько удлиняется (0,124 нм вместо 0,121 нм), а связь C-N несколько укорачивается (0,132 нм вместо 0,147 нм). Вследствие делокализации электронной плотности в p,π-сопряженной системе связи C-O и C-N становятся как бы «полуторными», поэтому вращение вокруг них затруднено. Такое электронное строение обусловливает жесткую плоскостную структуру пептидной связи:
Неподеленная пара электронов азота вступает в p,π-сопряжение с электронным облаком π-связи карбонильной группы, вследствие чего связь C=O несколько удлиняется (0,124 нм вместо 0,121 нм), а связь C-N несколько укорачивается (0,132 нм вместо 0,147 нм). Вследствие делокализации электронной плотности в p,π-сопряженной системе связи C-O и C-N становятся как бы «полуторными», поэтому вращение вокруг них затруднено. Такое электронное строение обусловливает жесткую плоскостную структуру пептидной связи:
 |

Качественной реакцией на пептидную связь является биуретовая реакция: при взаимодействии пептида с Cu(OH)2 наблюдается красновато-фиолетовое окрашивание. Обратите внимание, что эта реакция не характерна для дипептидов.
При единообразно построенной цепи пептиды и белки отличаются аминокислотным составом и аминокислотной последовательностью. Аминокислотный состав показывает, какие аминокислоты и в каких соотношениях входят в структуру пептидов и белков. Для определения аминокислотного состава пептид или белок подвергают гидролизу и гидролизат анализируют (чаще всего хроматографическими методами).
Пептидные связи гидролизуются и в кислой, и в щелочной среде. При кислотном гидролизе пептидов образуются соли аминокислот по аминогруппе, при щелочном гидролизе – соли по карбоксильной группе:
 |
Практически для гидролиза пептидов и белков используют кислотный катализ, т.к. многие аминокислоты в щелочной среде неустойчивы. Полный кислотный гидролиз любого белка протекает при его нагревании с 20% раствором соляной кислоты при 110оС в течение 24 час. Некоторые аминокислоты (например, триптофан) разрушаются и в кислой среде.
Более удобным является ферментативный гидролиз пептидов и белков. Ферментативный гидролиз протекает под действием ферментов – пептидаз. Определенные пептидазы расщепляют пептидные связи между остатками определенных аминокислот. Например, трипсин гидролизует связи, образованные лизином или аргинином с другими аминокислотами, пепсин – связи между аминокислотами с гидрофобными радикалами (аланин, валин, лейцин, изолейцин), химотрипсин – связи, образованные ароматическими аминокислотами. Чтобы осуществить полный ферментативный гидролиз, нужно использовать набор различных ферментов.
При ферментативном гидролизе образуются свободные аминокислоты.
Первичная структура белков – это определенная аминокислотная последовательность, т.е. порядок чередования аминокислотных остатков в полипептидной цепи. Определение аминокислотной последовательности заключается в последовательном отщеплении аминокислотных остатков с N- или C-конца и их идентификации. Существуют различные методы определения аминокислотной последовательности, один из них – фенилтиогидантоиновый, или метод Эдмана.
Этот метод заключается во взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде:
 |
Образуется так называемый меченый полипептид, в структуре которого появился остаток фенилизотиоцианата (это реакция AN). При обработке меченого пептида слабой кислотой при комнатной температуре происходит внутримолекулярная циклизация в фенилтиогидантоиновое производное (ФТГ-производное) с одновременным гидролизом пептидной связи:
 |
ФТГ-производное идентифицируется методом тонкослойной хроматографии. Преимущество метода Эдмана в том, что остальная часть пептидной молекулы не нарушается, и можно повторять операции по отщеплению следующей N-концевой аминокислоты. Сейчас этот метод воспроизводится в автоматическом приборе, который осуществляет до 50 стадий отщепления и автоматически анализирует ФТГ-производные.
Для белков, наряду с первичной структурой, характерны более высокие уровни организации – вторичная, третичная и четвертичная структуры.
Под вторичной структурой белка понимают пространственное расположение атомов полипептидной цепи. Существует два типа вторичной структуры – α-спираль и β-складчатая структура.
На основании теоретических расчетов в 1950 г. Полинг и Кори доказали, что для полипептидной цепи наиболее выгодной конформацией является α-спираль – структура, сходная с правозакрученной винтовой лестницей (рис. 5). Поскольку α-спираль построена из повторяющихся единиц –NH-CHR-CO-, то размеры ее относительно постоянны. На один виток спирали приходится 3,6 аминокислотных остатка, шаг спирали 0,54 нм, диаметр – 0,5 нм. Плоскости двух соседних пептидных групп находятся под углом ~108о, боковые радикалы находятся на наружной стороне спирали (направлены как бы от цилиндра).
Фиксируют такую спиральную конформацию водородные связи, которые возникают между атомом кислорода карбонильной группы каждого первого аминокислотного остатка и атомом водорода NH-группы каждого пятого остатка:
 |
 Водородные связи почти параллельны оси спирали, а так как каждая C=O и NH-группы α-спирали участвуют в образовании водородной связи, это делает вторичную структуру весьма устойчивой.
Водородные связи почти параллельны оси спирали, а так как каждая C=O и NH-группы α-спирали участвуют в образовании водородной связи, это делает вторичную структуру весьма устойчивой.
Рис. 5. Фрагмент белковой α-спирали.
Другим видом вторичной структуры является β-складчатая структура. В складчатые листы укладываются вытянутые полипептидные цепи, связываемые множеством водородных связей между пептидными группами этих цепей. Складчатый лист включает обычно не более шести полипептидных цепей. Если полипептидные цепи имеют одинаковую направленность от N- к C-концу, то образуется параллельная β-структура, если противоположную – то антипараллельная:
 |
Многие белки содержат одновременно и α-спиральные, и
β-складчатые уча
|
из
5.00
|
Обсуждение в статье: В структуре всех восстанавливающих дисахаридов есть свободный полуацетальный гидроксил |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

