 |
Главная |
Основы термодинамики: внутренняя энергия, число степеней свободы. Закон равномерного распределения энергии по степеням свободы
|
из
5.00
|
Внутренняя энергия – энергия хаотичного движения молекул и энергия взаимодействия этих частиц.
Число степеней свободы - наименьшее число независимых координат, определяющих положение и конфигурацию молекулы в пространстве.
Закон равномерного распределения энергии по степеням свободы молекул можно сформулировать следующим образом: статистически в среднем на каждую степень свободы молекул приходится одинаковая энергия. Поступательное движение молекул характеризуется средней кинетической энергией, равной  . Так как поступательному движению соответствует 3 степени свободы, то в среднем на одну степень свободы движения молекул приходится энергия
. Так как поступательному движению соответствует 3 степени свободы, то в среднем на одну степень свободы движения молекул приходится энергия 
В однородном газе, молекулы которого имеют любое число степеней свободы i, каждая молекула в среднем обладает энергией движения, равной 
Первое начало термодинамики. Работа газа при изменении его объёма. Теплоёмкость газа.
Превращение энергии. Идёт на изменение энергии U и совершение работы A:
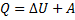

 Работа газа при изменении его объёма:
Работа газа при изменении его объёма:

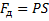

Площадь под графиком с осями P, V пропорциональна работе газа.
Теплоёмкость – количество теплоты, переданной системе.
 (удельная теплоёмкость тела)
(удельная теплоёмкость тела)
Теплоёмкость при постоянном объёме:
V=const (A=0)



Теплоёмкость при постоянном давлении:
P=const


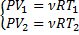 ⇒ PdV=νRdT ⇒
⇒ PdV=νRdT ⇒
 (уравнение Майера)
(уравнение Майера)

Первое начало термодинамики. Применения первого начала термодинамики к изопроцессам.
Изохорный процесс:
V=const, dV=0, dA=PdV=0
⇒ Первое начало: dQ=dU=CVνdT
Изобарный процесс:
P=const
Первое начало: dQ=dU+dA
R=A/νdT (универсальная газовая постоянная)
Изотермический процесс:
T=const
Первое начало: dQ=dA

Адиабадный процесс:
Процесс при котором отсутствует теплообмен, т.е. dQ=0.
Первое начало: dU+dA=0
dA=-dU


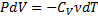

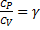 (показатель адиабаты, или коэффициент Пуассона)
(показатель адиабаты, или коэффициент Пуассона)



PVγ=const
Реальные газы. Уравнение Ван-дер-Вальса.
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
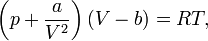
где
- p — давление,
- V — объём,
- T — абсолютная температура,
- R — универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:

|
из
5.00
|
Обсуждение в статье: Основы термодинамики: внутренняя энергия, число степеней свободы. Закон равномерного распределения энергии по степеням свободы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

