 |
Главная |
Равновесие в гетерогенной системе “осадок - раствор”. Произведение растворимости. Факторы, влияющие на растворимость осадков
|
из
5.00
|
При соприкосновении какого–либо малорастворимого вещества с водой в системе осуществляются два процесса:
1) в результате взаимодействия ионов – в-ва с полярными молекулами воды, ионы отрываются от поверхности и вследствие диффузии распределяются по всему объему раствора.
2) по мере накопления ионов в растворе идет обратный процесс, ионы из раствора сталкиваются с поверхностью твердой фазы, притягиваются к ней и входят в состав кристаллической решетки.
В конечном итоге в системе устанавливается равновесие между твердой фазой и ионами в растворе.
υраст = υос
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным.
К данной равновесной системе можно применить закон действия масс и количественно охарактеризовать константой равновесия:

 - активность катиона;
- активность катиона; 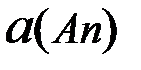 - активность аниона;
- активность аниона; 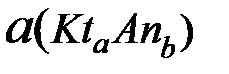 - активность твердого вещества; К0 – термодинамическая константа равновесия.
- активность твердого вещества; К0 – термодинамическая константа равновесия.
Т.к. активность твердого вещества – постоянная величина, следовательно
К0∙ 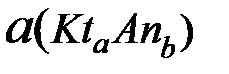 = const. Эта константа обозначается ПР0 и называется произведением растворимости.
= const. Эта константа обозначается ПР0 и называется произведением растворимости.
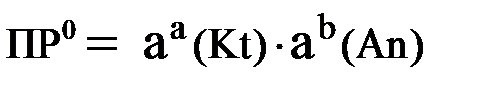
Произведением растворимости называется произведение активностей ионов малорастворимого электролита в его насыщенном растворе, в степенях, равных соответствующим стехиометрическим коэффициентам.
Произведение растворимости является для каждого малорастворимого электролита при данной температуре величиной постоянной и не зависит от активностей ионов (при этом относительные концентрации ионов могут изменяться в широких пределах). Величину ПР0 называют также термодинамическим произведением растворимости или произведением активности.
В реальных растворах удобнее пользоваться не активностями, а концентрациями ионов:
ПР = [Kt]а·[An]b
Величину ПР называют концентрационным (или реальным) произведением растворимости. Эта величина в отличие от ПР0 зависит не только от природы электролита и растворителя, но и от ионной силы раствора.
ПР0 = [Kt]а·[An]b·γ а(Kt) ·γ b(An)
Отсюда связь между различными произведениями растворимости выражается формулой:

В тех случаях, когда произведение растворимости невелико (для бинарных электролитов ПР0 < 10-7 ) величина активности близка к концентрации (а ≈ с, γ ≈1) и для расчетов можно пользоваться концентрационным произведением растворимости.
Условия образования осадков
В насыщенном растворе при данной температуре содержится максимально возможное количество растворенного вещества.
Раствор, содержащий вещества меньше, чем в насыщенном растворе называется ненасыщенным. В таком растворе может раствориться дополнительное количество вещества до достижения состояния насыщения. В ненасыщенном растворе скорость растворения больше, чем скорость осаждения(υраст > υос), а произведение активностей (концентраций) ионов меньше произведения растворимости.
При определенных условиях для некоторых веществ могут существовать пересыщенные растворы, в которых содержится вещества больше, чем в насыщенных. Такие растворы не устойчивы, из них легко осаждается избыточное количество вещества до тех пор, пока раствор не станет насыщенным.
В пересыщенном растворе скорость осаждения больше скорости растворения (υос > υраст), а произведение активностей (концентраций) ионов больше произведения растворимости.
На основании этих закономерностей можно предсказать, выпадет ли осадок при смешении растворов определенной концентрации.
Растворимость
Растворимость (S) представляет собой концентрацию вещества в его насыщенном растворе при данной температуре. Как правило, растворимость измеряют в моль/л.
Обычно величину произведения растворимости вычисляют на основании данных растворимости, найденных экспериментальным путем. В то же время, зная ПР, можно рассчитать растворимость вещества.
Ионная растворимость равна
S= 
Для бинарных электролитов (a=b=1):
S= 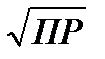
Факторы, влияющие на растворимость осадков
|
из
5.00
|
Обсуждение в статье: Равновесие в гетерогенной системе “осадок - раствор”. Произведение растворимости. Факторы, влияющие на растворимость осадков |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

