 |
Главная |
Равновесие в буферных растворах. Сущность буферного действия. Расчет рН буферных растворов. Буферная емкость
|
из
5.00
|
Если к воде или водным растворам сильных кислот и оснований и многих солей добавить небольшое количество сильной кислоты или сильного основания рН раствора сильно изменится.
Если к 1 литру воды (рН=7) прибавить 0,001 моль р-ра HCl (С HCl=10-3 моль/л), то рН раствора станет равное 3 (рН=3).
Во многих случаях при проведении анализа необходимо поддерживать рН на определенном уровне, для этого используют буферные растворы, в которых при добавлении небольшого количества сильной кислоты или сильного основания рН изменяется не значительно.
Буферные растворы регулируют концентрацию ионов Н+ и ОН- уменьшая влияние различных факторов изменения рН.
Как правило, буферные растворы состоят из слабой кислоты и ее соли (СН3СООН+СН3СООNa–ацетатный кислотный буферный раствор) или слабого основания и его соли (NH3·H2O+NH4Cl–аммиачный (аммонийный) щелочной раствор).
Расчет рН в буферных растворах
1) для кислотного буферного р-ра





Если 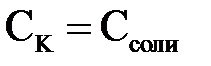 , тогда pH=pK
, тогда pH=pK
2) для щелочного буферного р-ра





Если  , тогда pH=14-pK
, тогда pH=14-pK
Сущность буферного действия
При добавлении к буферному раствору небольшого количества сильной кислоты или щелочи, один из компонентов буферного раствора взаимодействует с добавленным реагентом, при этом концентрации компонентов изменяются, но их отношение, а особенно логарифм этого отношения изменяется незначительно.
Пример. Как изменяется рН ацетатного буферного раствора, содержащего по 1 моль/л каждого из компонентов:
а) при добавлении 0,1моль/л НСl;
б) при добавлении 0,1 моль/л NaOH.
Ск-ты=1моль/л, Ссоли=1 моль/л, С NaOH=0,1 моль/л, СHCl=0,1 моль/л, КК=1,8*10-5.
Рассчитаем рН исходного буферного р-ра:
рН=рК=-lg 1,8·10-5=4,75.
CH3COONa+HCl  CH3COOH + NaCl.
CH3COOH + NaCl.
Концентрация соли уменьшается, концентрация кислоты увеличивается на столько, на сколько добавлено реагентов

 .
.
CH3COOH+NaOH  CH3COONa+H2O
CH3COONa+H2O


Буферная емкость
Способность буферного раствора поддерживать рН количественно характеризуется буферной емкостью (π).
π – это количество сильной кислоты или основания, которое следует добавить к 1 литру буферного раствора, чтобы его рН изменился на 1.
Буферная емкость зависит от качественного состава буферного раствора и от концентрации компонентов.
Чем больше концентрация, тем выше буферная емкость.
При прочих равных условиях максимальной буферной емкостью обладают растворы с одинаковой концентрацией компонентов.
 ;
; 
Наиболее часто в химическом анализе применяются следующие буферные растворы (рН приведено для одинаковой концентрации компонентов):
| ацетатный | СН3СООН + СН3СООNa | рН = 4,75 |
| аммиачный | NH3·Н2О + NH4Cl | рН = 9,25 |
| формиатный | НСООН + НСООNa | рН = 3,75 |
| корбанатный | Na2CO3 + NaHCO3 | рН = 10,32 |
| фосфатный | Na2HPO4 + NaH2PO4 | рН = 6,6 |
Буферными являются растворы некоторых индивидуальных солей: Na2B4O7, (NH4)2CO3, (NH4)2S, т.к. эти соли обладают высокой степенью гидролиза и в их растворах образуются компоненты необходимые для осуществления буферного действия.
|
из
5.00
|
Обсуждение в статье: Равновесие в буферных растворах. Сущность буферного действия. Расчет рН буферных растворов. Буферная емкость |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

