 |
Главная |
Методы проведения гравиметрического анализа
|
из
5.00
|
Различают три группы методов проведения гравиметрического анализа — методы выделения, отгонки и методы осаждения.
Методы выделения.Эти методы основаны на выделении определяемого вещества в твердую фазу в элементарном виде. Например, при определении сульфата меди в образце, содержащем индифферентные примеси, навеску образца растворяют и осаждают образовавшиеся ионы меди в виде металла (Сu2++ H2®Cu0¯+ 2H+), который отфильтровывают, промывают, высушивают и взвешивают на аналитических весах. Измерив массу выделенной меди рассчитывают массу сульфата меди и его массовую долю в образце.
Методы отгонки. Эти методы основаны на измерении точной массы выделившихся в процессе анализа газообразных продуктов. Методы отгонки применяются в нескольких вариантах: а) определяемое вещество отгоняют из точной навески исследуемого образца и по уменьшению ее массы судят о содержании летучего компонента, например, таким способом определяют количество гигроскопической влаги в веществе и кристаллизационной воды в солях, высушивая навеску образца при определенной температуре до постоянной массы (см. разд.II, раб.5); б) определяемое вещество переводят химическим путем в летучее состояние и отгоняют, например, при анализе силикатов, содержащейся в них диоксид кремния (SiO2) действием плавиковой кислоты (HF) переводят в летучий продукт – тетрафторид кремния (SiF4), который отгоняют из образца и по убыли массы навески рассчитывают содержание кремния; в) определяемое вещество переводят в летучее состояние, отгоняют и поглощают каким-либо поглотителем, по увеличению массы которого рассчитывают содержание компонента, например, при определении карбоната кальция в известняке выделяют CО2 (действием на СаСО3 кислоты или прокаливанием), пропускают его через газопоглотительную трубку с натронной известью или аскаритом, по увеличению массы трубки определяют массу поглощенного углекислого газа и рассчитывают массу и массовую долю карбоната кальция в анализируемом образце.
Методы осаждения. Эти методы основаны на довольно простой общей схеме определения, когда навеску анализируемого образца (mнав), содержащего определяемое вещество (В), переводят в раствор и добавляют избыток реагента-осадителя (А). Образовавшийся осадок (форма осаждения ВbАa) отфильтровывают, промывают, высушивают (прокаливают) до постоянной массы (весовая форма С) и взвешивают на аналитических весах.
Гравиметрический анализ методом осаждения включает в себя следующие основные этапы:
- взятие навески анализируемого образца и перевод её в раствор;
- перевод определяемого вещества в форму осаждения (осаждение);
- отделение осадка от раствора (фильтрование) и удаление примесей (промывание);
- перевод формы осаждения в весовую (гравиметрическую) форму;
- взвешивание весовой формы на аналитических весах;
- расчет результатов анализа.
Выводы: Гравиметрический метод (гравиметрия)применяется при анализе многих веществ, том числе и фармацевтических препаратов, на содержание летучих компонентов, влаги, остаточной золы
Основным недостатком гравиметрического метода является длительность определений, которая в ряде случаев может достигать нескольких десятков часов, что практически исключает применение этого метода для текущего технологического контроля производства и при проведении экспресс-анализа.
Методы выделения.Эти методы основаны на выделении определяемого вещества в твердую фазу в элементарном виде.
Методы отгонки. Эти методы основаны на измерении точной массы выделившихся в процессе анализа газообразных продуктов.
Методы осаждения. Эти методы основаны на довольно простой общей схеме определения, когда навеску анализируемого образца (mнав), содержащего определяемое вещество (В), переводят в раствор и добавляют избыток реагента-осадителя (А).
Вопросы:
1. В чем заключается сущность гравиметрических определений по методу осаждения? Приведите примеры.
2. В чем заключается сущность гравиметрических определений по методу отгонки? Приведите примеры.
3. В чем заключается сущность гравиметрических определений по методу выделения? Приведите примеры.
Лекция №9
Тема: Объемный метод анализа
Цель:
Обучающая–изучить применение объемного метода анализа, рассмотреть основные понятия и сущность данного метода анализа;
Развивающая – развивать навыки устной и письменной речи, умении быстро выражать свои мысли четко и логично;
Воспитательная – воспитать умение слушать других, приобщать обучающихся к активности, самостоятельности
Ход урока:
- Организационный момент – 2 минуты
- Этап подготовки к усвоению нового материала- 5 минут
3. Чтение лекции – 32 минуты
4. Обобщение и систематизация полученных знаний -5 минут
5. Закрепляющие вопросы- 5 минут
План:
1. Объемный (титриметрический) метод анализа.
2. Классификация методов и способов титрования
Титриметрический анализ основан на точном измерении количества реактива израсходованного на реакцию с определяемым веществом.
В том случае, если способ измерения количества вещества является измерение объема раствора, то такой вид анализа называется объемным.
В титриметрии для определения содержания определяемого вещества находят по объему раствора реагента, израсходованного на реакцию с ним. Концентрация раствора реагента должна быть известна с высокой точностью. Такие растворы называют титрованными или стандартными. Часто его также называют рабочим раствором или титрантом, а анализируемый титруемый раствор – аналитом.
Титрование – это постоянное добавление раствора титранта к титруемому раствору.
Точка эквивалентности (т.э.) – это момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества.
При достижении т.э. в титриметрии справедлив закон эквивалентов.
Стандартизация раствора титранта – это установление его точной концентрации.
Стандартизация раствора
Метод Метод
приготовленных растворов установленных растворов
отдельных пипетирования по установленным
навесок (стандартным) веществам
Метод фиксанала
Для стандартизации раствора установочным веществом может быть химическое вещество удовлетворяющее определенным требованиям.
Методы титриметрического анализа классифицируют по
·типу основной реакций титрования
·методы титрования
·способы титрования
Классификация методов по реакции титрования:
·методы кислотно-основного взаимодействия (процесс передачи протона)
·методы окисления-восстановления (процесс обмена электронов) объединяют на многочисленную группу ОВР, перманганатометрия, иодометрия и др;
·методы комплексообразования используют реакции образования координационных соединений: комплексонометрия, меркуриметрия и др.;
·методы осаждения основаны на реакциях образования малорасторимых соединения: аргентометрия, меркурометрия и др.
Методы титрования
·прямое титрование
·обратное титрование (титрование по остатку)
·заместительное титрование
Способы титрования
·титрование способом пипетирования
·титрование способом отдельных навесок
Вычисления результатов определений в титриметрии
Расчеты в титриметрическом анализе опираются на понятия фактора эквивалентности (fэ) молярной массы эквивалента (Мэ) и способами выражении концентрации – молярной концентрации эквивалента (Сэ) и молярной концентрации (С).
В титриметрическом анализе используются особым способом выражения концентрации – через титр (Т).
·титр по рабочему веществу (Тр.в.) или просто титр:
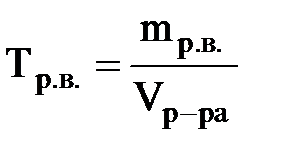
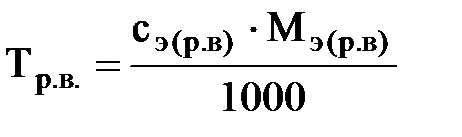 ; размерность г/мл или г/см3
; размерность г/мл или г/см3
·Титр по определяемому веществу:
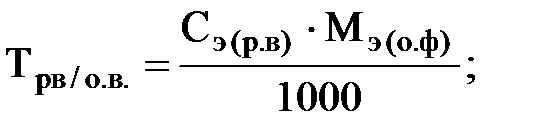 Vр-ра – в мл
Vр-ра – в мл
·При определении концентрации анализируемого раствора, согласно следствию из закона эквивалентов, исходят из основного положения титриметрического анализа: объемы двух растворов, нацело реагирующих между собой, обратно пропорциональны нормальным концентрациям этих растворов.
Сэ(1) ·V(1) = Сэ(2) · V(2) где : Сэ(1), V(1) – нормальная концентрация и объем одного раствора
Сэ(2), V(2) – нормальная концентрация и объем другого раствора.
Выводы: Титриметрический анализ основан на точном измерении количества реактива израсходованного на реакцию с определяемым веществом.
Титрование – это постоянное добавление раствора титранта к титруемому раствору.
Точка эквивалентности (т.э.) – это момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества.
Методы титриметрического анализа классифицируют по
·типу основной реакций титрования
·методы титрования
·способы титрования
Вопросы:
1. Дайте определение понятию титрование
2. Начем основан данный метод
3. Как классифицируют титриметрический метод анализа
Лекция №10
Тема: Метод окисления-восстановления.
Цель:
Обучающая–изучить применение окислительно-восстановительных методов анализа, рассмотреть их назначение в проведении химико-технологического контроля.
Развивающая – развивать навыки устной и письменной речи, умении быстро выражать свои мысли четко и логично;
Воспитательная – воспитать умение слушать других, приобщать обучающихся к активности, самостоятельности
Ход урока:
- Организационный момент – 2 минуты
- Этап подготовки к усвоению нового материала- 5 минут
3. Чтение лекции – 32 минуты
4. Обобщение и систематизация полученных знаний -5 минут
5. Закрепляющие вопросы- 5 минут
План:
1. Сущность метод окисления-восстановления.
2. Назначение метода при проведении химико-технологического контроля.
Окислительно-восстановительным титрованием (О.В.Т.) или редоксиметрией называют определение веществ титрованием растворами окислителей или восстановителей.
ОВТ классифицируют в зависимости ОВР рабочего раствора окислителя или восстановителя. Наиболее распространенными являются:
·перманганатометрия – реакция окисления КМnО4;
·иодометрия – реакция окисления J2 или восстановления J- ;
·дихроматометрия – реакция окисления К2Сr2О7;
·броматометрия – реакция окисления КВrО3
Схематически полуреакцию 2-х систем можно представить в общем виде:
Ок1 + Вос2 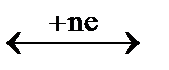 Вос1 + Ок2
Вос1 + Ок2
-nē
В ОВР участвуют компоненты обратимых редоксипар Ок1/Вос1 и Эк2/Вос2.
Направление ОВР определяют по количественной характеристике относительной силы редокс-пар – окислительно-восстановительного потенциала (ОВП). Измерения ОВП проводят с помощью гальванического элемента, получающие при этом ОВП называют стандартным потенциалом – Е0.
·стандартный потенциал – мера способности ионов отнимать или принимать электроны
·чем больше Е0 ОВП, тем более сильным окислителем является ее окисленная форма, тем более слабым восстановителем – восстановленная форма.
·более сильный из 2-х окислителей отнимает электроны у более слабого восстановителя и окислителя
·ОВР может быть использована в редоксиметрии, если:
Е(э.д.с.) = Е0(Ок) - Е0(Вос) > 0 .
Зависимость ОВП от условий протекания ОВР выражают уравнением Нернста:
Для простейшей обратимой редокс-системы: 
Ок + ne ↔ Вос
ОВП определяется уравнением Нернста:
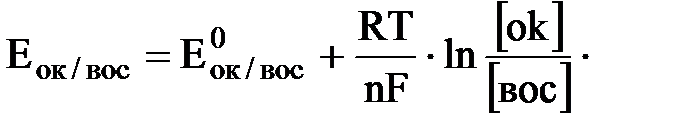
Факторы, влияющие на ОВП
·температура
из уравнения Нернста следует, что чем выше температура, тем больше ОВП системы
·концентрация реагирующих веществ
Если в ОВР имеются стехиометрические коэффициенты, они входят в уравнение Нернста в виде показателей степеней при соответствующих концентрациях. Так для пары аОк/ aВос (общий случай)
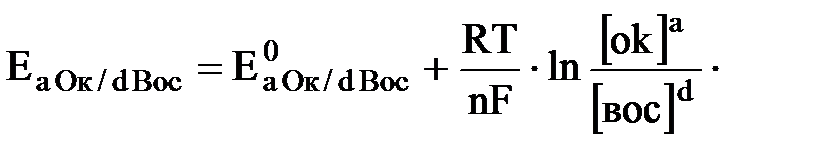
·Концентрация ионов водорода (Н+)
в ОВР принимает участие m ионов водорода
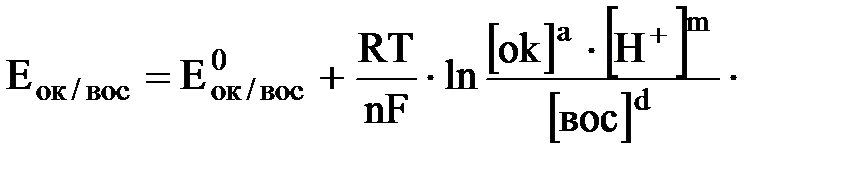
Подставив в уравнение Нернста численные значения констант (R, F), Т= 293 К, преобразовав натуральный логарифм в десятичный (модуль перехода 2,3) уравнение запишется:
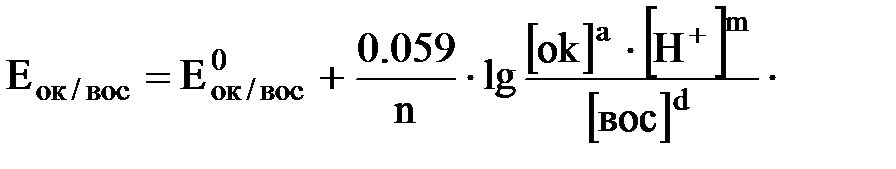
В титриметрическом анализе применяют ОВР которые:
·протекают до конца (не обратимы);
·проходят быстро и стехиометрично;
·образуют продукты определенного химического состава
·позволяют точно фиксировать т.э.
·не вступают в реакции с побочными продуктами, присутствующими в исследуемом растворе.
Факторы, влияющие на скорость ОВР
·концентрация реагирующих веществ
·температура
·рН среды
·присутствие катализатора
Константа равновесия ОВР (К):
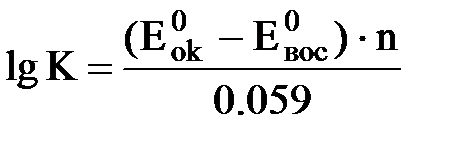
Следовательно, константа равновесия будет больше, чем больше разность стандартных потенциалов обеих ОВП.
Кривые титрования в редоксиметрии строят в координатах Е – V. Расчет ОВП в различных точках титрования и форма кривой титрования аналогично как в кислотно-основном титровании.
Е
т.э V, мл
Скачок титрования: чем больше разность стандартных потенциалов, тем больше константа равновесия, тем больше скачок титрования и тем больший выбор индикатора.
Индикаторы ОВ титрования
В методах редоксиметрии т.э. можно фиксировать следующими способами:
·применением ОВ индикаторов, изменяющих окраску в зависимости от ОВП системы
·по окраске от избытка прибавленного раствора – безиндикаторное (перманганатометрия)
·введением в раствор веществ (специфические индикаторы образующие с рабочим раствором или с определяемым веществом окрашенного соединения (иодометрия)
·введением в раствор необратимых индикаторов, которые окисляются или восстанавливаются избытком рабочего раствора, вследствие чего окраска изменяется (броматометрия).
Перманганатометрия
Окислительные свойства КМnО4 в значительной степени зависят от среды, в которой протекает реакция
рН<4 малин. МnО4- + 8Н+ + 5е- = Мn2+ + 4Н2О , Е0=1,51В, Мэ= 1/5М
фиол. цвет бесцв.
рН 5-8 МnО4- +2Н2О + 3е- = МnО2 ↓ + 4ОН-, Е0=0,60В, Мэ= 1/3М
бурого цв.
рН>9 МnО4- + е - = МnО4 2- , Е0=0,56В, Мэ= М
зел.цв.
Наиболее распространено титрование в кислой среде т.к.:
·окислительная способность КМnО4 довольно таки высокая
·в щелочной и нейтральных средах затруднено фиксирование т.э.
Рабочий раствор КМnО4 готовят по:
·методу установочных веществ
·методом фиксанала
Методом прямого пермангантометрического титрования определяют любые восстановители с меньшей алгебраической величиной электродного потенциала, чем у перманганата.
Иодометрия
Основная реакция при иодометрических определениях:
J2 + 2e- « J2 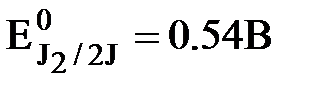
Пара J2/2J- - расположена примерно в середине таблицы ОВП, поэтому она имеет двойственный характер и применяется в качестве окислителя и восстановителя. В этом заключается универсальность метода.
Определение восстановителей
2S2О32- + J2 → 2J- + S4О62-
В конце титрования окраска иода слаба, что затрудняет фиксирование т.э. Поэтому, в качестве индикатора применяют специфический индикатор- крахмал.
Определение окислителей
Cr2О72- + 6J- + 14Н+ → 3J2 + 2Сr3+ + 7Н2О
В действительности такое титрование провести нельзя, т.к. нельзя зафиксировать момент прекращения образования J2, а следовательно и т.э.
В этом случае применяют косвенный метод – метод замещения.
Выводы: Окислительно-восстановительным титрованием (О.В.Т.) или редоксиметрией называют определение веществ титрованием растворами окислителей или восстановителей.
Скачок титрования: чем больше разность стандартных потенциалов, тем больше константа равновесия, тем больше скачок титрования и тем больший выбор индикатора.
В основе ОВ процесса лежит закон электронейтральности: если одно вещество окисляется отдавая определенное число электронов, то одновременно другое вещество восстанавливается, принимая электроны. Закон электронейтральности является следствием закона сохранения материи.
Вопросы:
1.Дайте определение ОВТ
2. Что лежит в основе ОВТ
3. Какие факторы влияют на ОВТ
4. В какой среде наиболее распространено титрование и почему
Лекция №11
Тема: Методы осаждения и комплексообразования
Цель:
Обучающая–изучить применение методов комплексообразования и осаждения анализа, рассмотреть их назначение в проведении химико-технологического контроля.
Развивающая – развивать навыки устной и письменной речи, умении быстро выражать свои мысли четко и логично;
Воспитательная – воспитать умение слушать других, приобщать обучающихся к активности, самостоятельности
Ход урока:
- Организационный момент – 2 минуты
- Этап подготовки к усвоению нового материала- 5 минут
3. Чтение лекции – 32 минуты
4. Обобщение и систематизация полученных знаний -5 минут
5. Закрепляющие вопросы- 5 минут
План:
1. Сущность методов осаждения и комплексообразования
2. Аргентометрия ( метод МОРА), условия применения метода
Комплексонометрия (трилонометрия) - титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений. Трилон Б (комплексон III) образует внутрикомплексные соединения с катионами металлов за счет валентных связей с карбоксильными группами, вытесняя из них атомы водорода, а также за счет координационных связей ионов-комплексообразователей с атомами азота.
В растворе трилон Б диссоциирует на ионы:
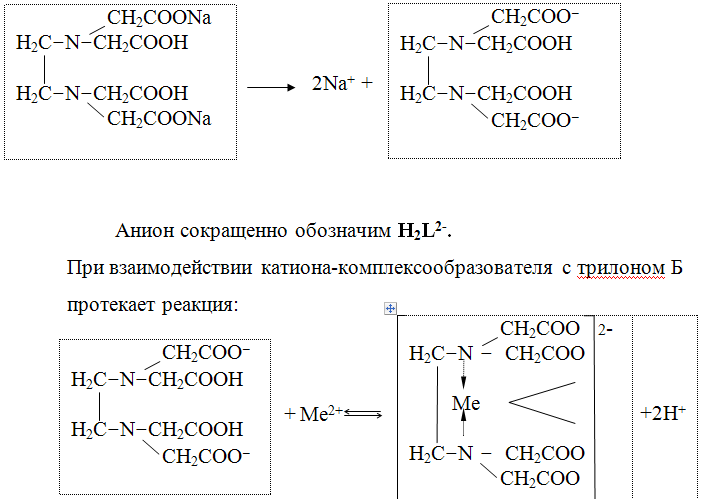
Во всех случаях независимо от степени окисления катионов они реагируют с комплексоном в соотношении 1: 1, поэтому фактор эквивалентности для ЭДТА и катионов металла равен 1.
Схематически реакции комплексообразования с катионами, имеющими различные степени окисления, можно представить следующими уравнениями:
H2L2- + Ме2+ ↔ [MeL]2- + 2Н+
H2L2- + Ме3+ ↔ [MeL]- + 2Н+
H2L2- + Ме4+ ↔ [MeL] + 2Н+
В качестве титранта используют растворы 0,1; 0,05 или 0,02 моль/дм3 трилона Б.
Методы осаждения используют для определения неорганических соединений галогенидов, цианидов, тиоцианатов, растворимых солей серебра, среди которых NaCl, КВг, КI, AgNО3 и др. входят в состав лекарственных форм. Эти методы также применяют для определения лекарственных препаратов: димедрола гидрохлорида, бромкамфоры, новокаина гидрохлорида и других. Титриметрические методы осаждения основаны на применении при титровании реакций, сопровождающихся образованием малораст-воримых соединений. От гравиметрического метода осаждения они отличаются тем, что при титровании к определяемому веществу прибавляют эквивалентное количество осадителя в виде стандарт-ного раствора. Содержание определяемого компонента (вещества) рассчитывают по величине объема титранта, израсходованного на осаждение определяемого вещества.
В аналитической химии известно много реакций, которые сопровождаются образованием малорастворимых соединений. Из них в количественном анализе могут быть использованы только те, которые отвечают следующим требованиям:
1.Реакция между определяемым веществом и стандартным раствором (титрантом) должна протекать в условиях, обеспечивающих образование осадка с минимальной растворимостью (S ≤ 10 -5 моль/дм3).
2.Реакция образования осадка должна протекать быстро, количест-венно, стехиометрично. При этом не должно наблюдаться образование пересыщенных растворов.
3.Должна быть возможность выбора индикатора для фиксирования конечной точки титрования.
4.Явления адсорбции и соосаждения не должны влиять на результаты определения.
Методы осаждения дают возможность количественно определять соединения, анионы которых образуют осадки с катионами:
- серебра Аg+ + Вr- ↔ AgВr↓
- ртути Hg22+ + 2Сl- ↔ Hg2Cl2↓
- бария Ва2+ + SO42- ↔ BaSO4↓
- свинца Pb2+ + CrO42- ↔ PcrO4↓
- цинка 3Zn22+ + 2К+ + 2[Fe(CN)6]22- ↔ Zn3К2[Fе(СN)6]2↓
Выводы:Комплексонометрия (трилонометрия) - титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений.
Методы осаждения используют для определения неорганических соединений галогенидов, цианидов, тиоцианатов, растворимых солей серебра, среди которых NaCl, КВг, КI, AgNО3 и др. входят в состав лекарственных форм.
Методы осаждения дают возможность количественно определять соединения, анионы которых образуют осадки с катионами
Вопросы:
1. Дайте определение понятию комплексонометрия
2. Какие методы осаждения вы знаете
3. Для чего используются методы осаждения
4. Какие анионы образуют с катионами осадки в методах осаждения
Лекция №12
Тема: Физико-химические методы анализа
Цель:
Обучающая–изучить физико-химические методы анализа, рассмотреть их назначение и классификацию ФХМА.
Развивающая – развивать навыки устной и письменной речи, умении быстро выражать свои мысли четко и логично;
Воспитательная – воспитать умение слушать других, приобщать обучающихся к активности, самостоятельности
Ход урока:
- Организационный момент – 2 минуты
- Этап подготовки к усвоению нового материала- 5 минут
3. Чтение лекции – 32 минуты
4. Обобщение и систематизация полученных знаний -5 минут
5. Закрепляющие вопросы- 5 минут
План:
- Возникновение ФХМА, задачи, понятие
- Классификация ФХМА
Овладение методами физико-химического анализа и умения применять их для изучения равновесий в различных системах является одним из важных этапов в подготовке современного специалиста химика-технолога. Возникновение предметапонятие физико-химического анализа было введено Н.С.Курнаковым в 1913 году. Зарождение предмета и метода ФХА проходило по следующим этапам.
До работ М.В.Ломоносова химия занималась исследованием качественных изменений, количественные наблюдения почти не проводились. В 1748 г. Ломоносов сформулировал закон сохранения массы и энергии. «Все перемены, в натуре встречающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько же присовокупится к другому. Так, ежели где убудет несколько материи, то умножится в другом месте… Сей общий естественный закон распространяется и в самые правила движения, ибо тело, движущее свою силою другое, столько же оныя у себя теряет, сколько сообщает другому, которое от него движение получает».
Позднее (1772-1789 гг.) работы Ломоносова были повторены А.Лавуазье, исследования которого стали широко известны и явились отправной точкой развития количественного анализа.
В дальнейшем были сформулированы важнейшие законы химии: закон эквивалентов (И.В. Рихтер, 1792 г.), закон кратных отношений (Д.Дальтон, 1803 г.), закон постоянства состава (Ж.Л.Пруст, 1806 г.), которые получили простое объяснение благодаря атомно-молекулярному учению Дальтона (1803-1808 гг.) Закон постоянства состава имел решающее значение для дальнейшего развития химии. Понятие о химическом соединении внесло в химию простоту и ясность, ограничило круг изучаемых веществ из огромного многообразия вещественных форм, но при этом из поля зрения науки выпали все классы веществ с переменным составом - растворы, расплавы, твердые растворы, стекла и т.д. Для исследования этих чрезвычайно сложных веществ не существовало в то время ни экспериментальных, ни теоретических методов. Сосредоточение внимания химиков на свойствах веществ позволило сформулировать такие законы, как теория строения органических соединений А.М.Бутлерова, периодический закон Менделеева. Благодаря понятию о химическом элементе стала быстро развиваться аналитическая химия.
Физико-химические или инструментальные методы анализа основаны на измерении с помощью приборов (инструментов) физических параметров анализируемой системы, которые возникают или изменяются в ходе выполнения аналитической реакции.
Физико-химические методы анализа (ФХМА) основаны на использовании зависимости физических свойств веществ (например, светопоглощения, электрической проводимости и т.д.) от их химического состава. Иногда в литературе от ФХМА отделяют физические методы анализа, подчёркивая тем самым, что в ФХМА используется химическая реакция, а в физических - нет. Физические методы анализа и ФХМА, главным образом в западной литературе, называют инструментальными, так как они обычно требуют применения приборов, измерительных инструментов. Инструментальные методы анализа в основном имеют свою собственную теорию, отличную от теории методов химического (классического) анализа (титриметрии и гравиметрии). Базисом этой теории является взаимодействие вещества с потоком энергии.
При использовании ФХМА для получения информации о химическом составе вещества исследуемый образец подвергают воздействию какого-либо вида энергии. В зависимости от вида энергии в веществе происходит изменение энергетического состояния составляющих его частиц (молекул, ионов, атомов), выражающееся в изменении того или иного свойства (например окраски, магнитных свойств и т.п.). Регистрируя изменение этого свойства как аналитический сигнал, получают информацию о качественном и количественном составе исследуемого объекта или о его структуре.
По виду энергии возмущения и измеряемого свойства (аналитического сигнала) ФХМА можно классифицировать следующим образом (табл.1).
Кроме перечисленных в таблице существует множество других частных ФХМА, не подпадающих под данную классификацию.
Наибольшее практическое применение имеют оптические, хроматографические и потенциометрические методы анализа.
Таблица 1.
| Вид энергии возмущения | Измеряемое свойство | Название метода | Название группы методов |
| Поток электронов (электрохимические реакции в растворах и на электродах) | Напряжение, потенциал | Потенциометрия | Электрохимические |
| Ток поляризации электродов | Вольтамперо - метрия, полярография | ||
| Сила тока | Амперометрия | ||
| Сопротивление, проводимость | Кондуктометрия | ||
| Импеданс (сопротивление переменному току, ёмкость) | Осциллометрия | ||
| Количество электричества | Кулонометрия | ||
| Масса продукта электрохимической реакции | Электрогравиметрия | ||
| Диэлектрическая проницаемость | Диэлкометрия | ||
| Электромагнитное излучение | Длина волны и интенсивность спектральной линии в =10-3...10-8 мlинфракрасной, видимой и ультрафиолетовой частях спектра | Оптические методы (ИК - спектроскопия, атомно-эмиссионный анализ, атомно-абсорбционный анализ, фотометрия, люминисцентный анализ, турбидиметрия, нефелометрия) | Спектральные |
| =10-8...10-11lТо же, в рентгеновской области спектра м | Рентгеновская фотоэлектронная, спектроскопия | ||
| Времена релаксации и химический сдвиг | Спектроскопия ядерномагнитного (ЯМР) и электронного парамагнитного (ЭПР) резонанса | ||
| Теплота | Температура | Термический анализ | Тепловые |
| Термограви – метрия | |||
| Количество теплоты | Калориметрия | ||
| Энтальпия | Термометрический анализ (энтальпиметрия) | ||
| Механические свойства | Дилатометрия | ||
| Энергия химических и физических (Ван-дер-Ваальсо-вые силы) взаимодействий | Электропроводность Теплопроводность Ток ионизации | Газовая, жидкостная, осадочная, ионообменная, гельпроникающая хроматографии | Хроматографические |
По сравнению с классическими химическими методами ФХМА отличаются меньшим пределом обнаружения, временем и трудоёмкостью. ФХМА позволяют проводить анализ на расстоянии, автоматизировать процесс анализа и выполнять его без разрушения образца (недеструктивный анализ).
По способам определения различают прямые и косвенные ФХМА. В прямых методах количество вещества находят непосредственным пересчётом измеренного аналитического сигнала в количество вещества (массу, концентрацию) с помощью уравнения связи. В косвенных методах аналитический сигнал используется для установления конца химической реакции (как своеобразный индикатор), а количество определяемого вещества, вступившего в реакцию, находят с помощью закона эквивалентов, т.е. по уравнению, непосредственно не связанному с названием метода.
По способу количественных определений различают без эталонные и эталонные инструментальные методы анализа.
Безэталонные методы основаны на строгих закономерностях, формульное выражение которых позволяет пересчитать интенсивность измеренного аналитического сигнала непосредственно в количестве определяемого вещества с привлечением только табличных величин. В качестве такой закономерности может выступать, например, закон Фарадея, позволяющий по току и времени электролиза рассчитать количество определяемого вещества в растворе при кулонометрическом титровании. Безэталонных методов очень мало, поскольку каждое аналитическое определение представляет собой систему сложных процессов, в которых невозможно теоретически учесть влияние каждого из многочисленных действующих факторов на результат анализа. В связи с этим при анализах пользуются определёнными приёмами, позволяющими экспериментально учесть эти влияния. Наиболее распространённым приёмом является применение эталонов, т.е. образцов веществ или материалов с точно известным содержанием определяемого элемента (или нескольких элементов). При проведении анализа измеряют определяемое вещество исследуемого образца и эталона, сравнивают полученные данные и по известному содержанию элемента в эталоне рассчитывают содержание этого элемента в анализируемом образце. Эталоны могут быть изготовлены промышленным способом (стандартные образцы, стали-нормали) или приготовляются в лаборатории непосредственно перед проведением анализа (образцы сравнения). Если в качестве стандартных образцов применяют химически чистые вещества (примесей меньше 0.05%), то их называют стандартными веществами.
На практике количественные определения инструментальными методами осуществляют по одному из трёх способов: градуировочной функции (стандартных серий), стандартов (сравнения) или стандартных добавок.
Выводы: Возникновение предметапонятие физико-химического анализа было введено Н.С.Курнаковым в 1913 году.
Позднее (1772-1789 гг.) работы Ломоносова были повторены А.Лавуазье, исследования которого стали широко известны и явились отправной точкой развития количественного анализа
Физико-химические или инструментальные методы анализа основаны на измерении с помощью приборов (инструментов) физических параметров анализируемой системы, которые возникают или изменяются в ходе выполнения аналитической реакции.
По сравнению с классическими химическими методами ФХМА отличаются меньшим пределом обнаружения, временем и трудоёмкостью. ФХМА позволяют проводить анализ на расстоянии, автоматизировать процесс анализа и выполнять его без разрушения образца (недеструктивный анализ).
Вопросы:
1. Кем и когда было введено ФХМА
2. На чем основаны ФХМА
3. Как классифицируют по виду энергии возмущения и измеряемого свойства ФХМА
4. Как классифицируют по способам определения
5. Как классифицируют по способу количественных определений
6. На чем основан безэталонный метод
Лекция №13
Тема: Фотометрические методы анализа.
Цель:
Обучающая–изучить фотометрические, колориметрические и хроматогрфические методы анализа, рассмотреть их назначение.
Развивающая – развивать навыки устной и письменной речи, умении быстро выражать свои мысли четко и логично;
Воспитательная – воспитать умение слушать других, приобщать обучающихся к активности, самостоятельности
Ход урока:
- Организационный момент – 2 минуты
- Этап подготовки к усвоению нового материала- 5 минут
3. Чтение лекции – 32 минуты
4. Обобщение и систематизация полученных знаний -5 минут
5. Закрепляющие вопросы- 5 минут
План:
1. Закон Бугера – Ламберта - Бера
2. Методы нефелометрии и турбидиметрии
Атом, ион или молекула, поглощая квант света, переходит в более высокое энергетическое состояние. Обычно это бывает переход с основного, невозбужденного уровня на один из более высоких, чаще всего на первый возбужденный уровень.
Вследствие поглощения излучения при прохождении его через слой вещества интенсивность излучения уменьшается и тем больше чем выше концентрация светопоглощающего вещества.
Закон Бугера- Ламберта- Бера (основной закон светопоглощения) связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя. Чтобы учесть потери света на отражение и рассеяние, сравнивают интенсивности света прошедшего через исследуемый раствор и растворитель. При одинаковой толщине слоя в кюветах из одинакового материала, содержащих один и тот же растворитель, потери на отражение и рассеяние света будут примерно одинаковы у обоих пучков и уменьшение интенсивности света будет зависеть от концентрации вещества.
Уменьшение интенсивности света, прошедшего через раствор характеризуется коэффициентом пропускания (или просто пропусканием) Т:
Т = I/I0
I и I0 – соответственно интенсивности света, прошедше
|
из
5.00
|
Обсуждение в статье: Методы проведения гравиметрического анализа |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

