 |
Главная |
Проверка домашнего задания
|
из
5.00
|
Обобщение и систематизация полученныхзнаний
Выставление оценок
Домашняя работа: Подготовить доклад на тему: Реакции ионного обмена. Закон действия масс, его применение в аналитической химии.
СРСП № 3
На тему:Частные реакции катионов первой аналитической группы
Цель:
Обучающая– глубокое изучение различных явлений и законов по данной теме
Развивающая – формирование эффективных и устойчивых взаимосвязей между научной и образовательной деятельностью;
Воспитательная – приобщать обучающихся к активности, самостоятельности на занятиях
Ход урока:
1. Организационный этап- 3 минуты
2. Этап подготовки к усвоению материала СРСП -5 минут
3. Проверка домашнего задания- 27 минут
4. Обобщение и систематизация полученныхзнаний - 5 минут
5. Выставление оценок- 5 минут
Требования к знаниям:
- принципы аналитической классификации катионов и анионов, общую характеристику и частные реакции катионов первой аналитической группы;
- правила охраны труда и техники безопасности при работе с химическими веществами в лаборатории, методы противопожарной защиты при работе с ними;
Требования к умениям:
- характеризовать химические свойства катионов первой аналитической группы, проводить характерные реакции катионов в лаборатории;
- собирать приборы для выполнения опытов, выполнять их индивидуально.
Классификация катионов и анионов. Общая характеристика катионов первой аналитической группы и значение их в осуществлении химико-технологического контроля.
Реакции катионов первой аналитической группы: реакции катиона натрия (реакция с дигидроантимонатом калия, реакция окрашивания пламени), реакция катиона калия (реакция с гидротартратом и кобальтинитритом натрия), реакция катиона аммония (действие щелочей, реактива Несселера, реакция разложения солей аммония).
Обнаружение катионов в анализируемом растворе проводят в соответствии со схемой хода анализа смеси катионов I и II аналитических групп, которая приведена на рис. 8 и показывает последовательность проведения отдельных операций.
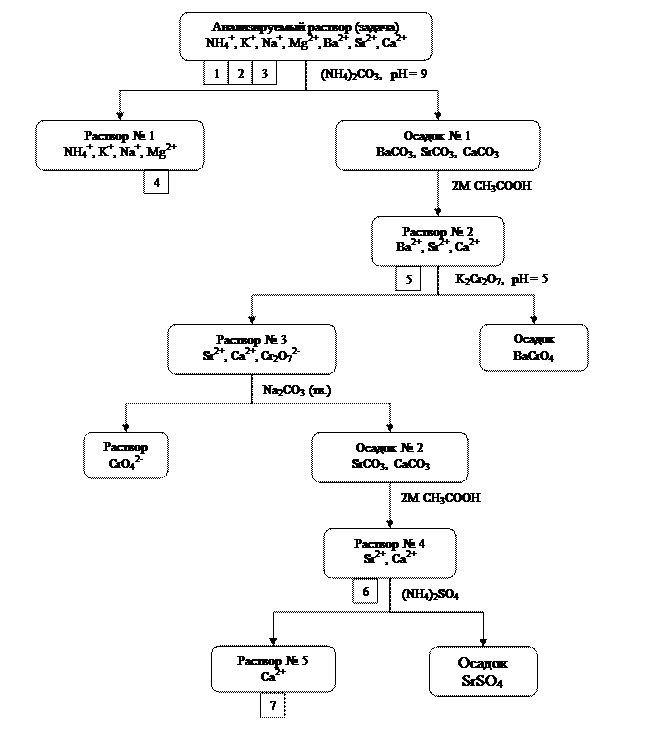
Рис 8. Схема хода анализа смеси катионов I и II аналитических групп
Цифрой в квадратике на схеме показан номер реакции обнаружения соответствующего катиона в пояснении к схеме.
Ход анализа раствора, содержащего катионы I и II аналитических групп, включает в себя элементы как дробного, так и систематического методов анализа.
Начинают анализ с дробного обнаружения ионов аммония, калия и натрия из отдельных порций анализируемого раствора, так как их открытию не мешают другие ионы, содержащиеся в задаче.
1. Для обнаружения NH4+-ионов 2-3 капли задачи помещают в чистую пробирку и проводят реакцию со щелочью (2.3.1), как указано в разд. 2.3.1, п. 1. Посинение универсальной индикаторной бумаги свидетельствует о присутствии ионов аммония в анализируемом растворе (выделение NH3); в противном случае определяемые ионы в смеси отсутствуют.
2. Если ионы аммония в задаче отсутствуют, то дробное обнаружение ионов K+ проводят по реакции с кобальтинитритом натрия (2.3.4) (см. разд. 2.3.3, п. 1), результатом которой является образование желтого осадка.
В случае присутствия в смеси NH4+-ионов, которые мешают определению ионов калия, реакцию следует проводить как описано в разд. 2.3.3, п. 2. При этом для определения берут 5-6 капель задачи, а осадок, образовавшийся после действия карбоната натрия и нагревания реакционной смеси на водяной бане, отделяют центрифугированием. Обнаружение ионов калия проводят в центрифугате, предварительно подкислив его 2 М раствором уксусной кислотой до рН = 5.
3. При обнаружении ионов натрия 1 каплю раствора цинкуранилацетата помещают на предметное стекло и под микроскопом проверяют его чистоту (в реактиве не должно содержаться никаких кристаллов). Затем добавляют 1 каплю задачи и через 1-2 минуты рассматривают реакционную смесь под микроскопом. Наличие октаэдрических и тетраэдрических кристаллов свидетельствует о присутствии ионов натрия (см. разд. 2.3.2, реакция 2.3.3, рис.5).
Обнаружение ионов Mg2+ по реакции с гидрофосфатом натрия (2.3.6) невозможно в присутствии катионовII аналитической группы, так как ионы бария, стронция и кальция образуют белый осадок малорастворимых фосфатов.
Для отделения катионов II аналитической группы в коническую пробирку помещают 20 капель анализируемой задачи, 10 капель 2 М раствора NH4OH и 10 капель 2 М раствора NH4Cl (рН = 9, контроль по универсальной индикаторной бумаге).. Затем к полученному раствору прибавляют 10 капель раствора карбоната аммония, реакционную смесь хорошо перемешивают и нагревают на водяной бане 1-2 минуты. Образовавшийся осадок карбонатов бария, стронция и кальция центрифугируют (осадок № 1) и, не отделяя его от раствора, проверяют полноту осаждения. Для этого осторожно по стенке пробирки прибавляют 1 каплю раствора (NH4)2CO3 и, если в прозрачном центрифугате не наблюдается образования осадка (помутнение), то полнота осаждения достигнута. В противном случае в пробирку следует добавить 5 капель раствора карбоната аммония, перемешать содержимое пробирки, нагреть на водяной бане и снова проверить полноту осаждения.
Добившись полного осаждения катионов II группы, раствор, содержащий катионы первой группы (центрифугат), сливают в чистую пробирку (раствор № 1) и определяют в нем ион магния по реакции (2.3.6) (см. разд. 2.3.4).
4. Для обнаружения ионов магния к 2-3 каплям раствора № 1 прибавляют 1-2 капли раствора гидрофосфата натрия и, при наличии магния, наблюдают образование белого осадка. Если осадок образовался, то 1 каплю сузпензии помещают на предметное стекло и рассматривают форму кристаллов под микроскопом. Наличие характерных кристаллов магнийаммонийфосфата (рис.6) подтверждает присутствие ионов магния в анализируемой задаче.
Микроскопическую реакцию обнаружения магния можно провести непосредственно на предметном стекле, для чего к 1 капле раствора № 1 добавляют 1 каплю раствора гидрофосфата натрия и полученный осадок рассматривают под микроскопом.
Если осадок в результате реакции не образуется или форма кристаллов не соответствует требуемой, то это означает, что ионы магния в растворе № 1, а значит и в задаче, отсутствуют.
Далее приступают к определению катионов второй аналитической группы. При этом сначала осадок карбонатов бария, стронция и кальция (осадок № 1) промывают дистиллированной водой, для чего добавляют к нему 20-25 капель воды, перемешивают и центрифугируют. Затем центрифугат выливают в отходы, а к осадку осторожно по каплям при перемешивании добавляют 2 М раствор уксусной кислоты до полного растворения. При необходимости реакционную смесь нагревают на водяной бане.
Полученный раствор (раствор № 2) используют для открытия ионов бария, стронция и кальция.
5. Для обнаружения ионов Ba2+ 3 капли раствора № 2 помещают в пробирку и прибавляют по 3 капли растворов ацетата натрия и дихромата калия. Образование желтого осадка указывает на присутствие ионов бария (реакция 2.3.7, разд. 2.3.5, п. 1).
Обнаружить ионы бария в растворе № 2 можно также по реакции (2.3.8), как это описано в разд. 2.3.5, п. 2. Образование розового осадка свидетельствует о наличии бария в анализируемом растворе.
Если ионы Ba2+ обнаружены, то их следует удалить из раствора, так как они мешают обнаружению ионов стронция и кальция. Для этого ко всему раствору № 2 прибавляют несколько капель раствора ацетата натрия до рН = 5 (контроль по универсальной индикаторной бумаге), после чего добавляют по каплям раствор K2Cr2O7до образования желтого осадка и появления оранжевой окраски раствора над ним, свидетельствующейоб избытке дихромат-иона. Осадок BaCrO4 центрифугируют и проверяют полноту осаждения бария, добавив к центрифугату 1 каплю раствора дихромата калия. Если полнота осаждения достигнута, то центрифугат сливают в чистую коническую пробирку (раствор № 3), а осадок отбрасывают в отходы.
Для удаления избытка дихромата калия, окраска которого может мешать дальнейшим определениям, к центрифугату (раствор № 3) добавляют твердый карбонат натрия до щелочной реакции (раствор становится светло-желтым). Содержимое пробирки нагревают на водяной бане, после чего выпавший осадок, который может содержать карбонаты стронция и кальция (осадок № 2), отделяют центрифугированием, промывают несколько раз дистиллированной водой и растворяют в нескольких каплях 2 М раствора уксусной кислоты. Полученный раствор (раствор № 4) исследуют на присутствие ионов стронция.
6. Для обнаружения ионов Sr2+ 5 капель раствора № 4 помещают в пробирку и прибавляют 5 капель насыщенного раствора CaSO4 (гипсовая вода) и нагревают на водяной бане несколько минут. Помутнение раствора указывает на присутствие ионов стронция (реакция 2.3.9, разд. 2.3.6).
Если ионы стронция присутствуют, их осаждают из всего раствора № 4 добавлением избытка (8—10 капель) раствора сульфата аммония при нагревании. Осадок SrSO4 отделяют центрифугированием и отбрасывают, а в центрифугате (раствор № 5) обнаруживают ион кальция, который находится там в виде хорошо растворимого комплекса (NH4)2[Ca(SO4)2].
7. Для обнаружения ионов Са2+ к 2-3 каплям раствора № 5 добавляют 2-3 капли раствора оксалата аммония. Образование белого осадка указывает на присутствие ионов кальция (реакция 2.3.10, разд. 2.3.7, п. 1).
Доказать присутствие ионов кальция в растворе № 5 можно также с помощью микрокристаллоскопической реакции , как описано в разд.2.3.7, п.2. Наличие характерных кристаллов гипса игольчатой формы (рис.7) подтверждает содержание ионов кальция в анализируемой задаче.
|
из
5.00
|
Обсуждение в статье: Проверка домашнего задания |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

