 |
Главная |
Б). Растворимость и ее виды; расчет растворимости
|
из
5.00
|
Для практических расчетов при оценке полноты осаждения пользоваться табличным произведением растворимости не всегда удобно, так как при одних и тех же значениях  концентрации в растворах различных веществ могут существенно варьировать. Гораздо проще сопоставлять содержание веществ в насыщенных растворах по их предельной концентрации (растворимости), так как в ней не содержится стехиометрических множителей. Растворимость характеризует предельно возможную при данной температуре концентрацию вещества в растворе до начала образования осадка. Такие растворы называют насыщенными, и они также образуют с осадком равновесную систему. В зависимости от способа выражения предельной концентрации различают несколько видов растворимости.
концентрации в растворах различных веществ могут существенно варьировать. Гораздо проще сопоставлять содержание веществ в насыщенных растворах по их предельной концентрации (растворимости), так как в ней не содержится стехиометрических множителей. Растворимость характеризует предельно возможную при данной температуре концентрацию вещества в растворе до начала образования осадка. Такие растворы называют насыщенными, и они также образуют с осадком равновесную систему. В зависимости от способа выражения предельной концентрации различают несколько видов растворимости.
1. Молярная растворимость  показывает количество моль вещества осадка находящегося в 1 л его насыщенного раствора при данной температуре. Ее рассчитывают по формуле:
показывает количество моль вещества осадка находящегося в 1 л его насыщенного раствора при данной температуре. Ее рассчитывают по формуле:
 , (12.4)
, (12.4)
где  – объем насыщенного раствора в мл, а
– объем насыщенного раствора в мл, а  – масса неосажденного вследствие растворимости вещества осадка.
– масса неосажденного вследствие растворимости вещества осадка.
2. Растворимость по массе  характеризует, сколько граммов данного вещества содержится в 1 л его насыщенного раствора. Растворимость по массе (
характеризует, сколько граммов данного вещества содержится в 1 л его насыщенного раствора. Растворимость по массе (  ) и молярная растворимость (
) и молярная растворимость (  ) связаны между собой простым соотношением:
) связаны между собой простым соотношением:
 (г/л). (12.5)
(г/л). (12.5)
Произведение растворимости малорастворимого соединения 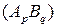 связано с его молярной растворимостью, так как они характеризуют одну и ту же систему раствор-осадок. Причем растворимость – со стороны осадка, а
связано с его молярной растворимостью, так как они характеризуют одну и ту же систему раствор-осадок. Причем растворимость – со стороны осадка, а  – характеризует концентрацию ионов осадка в насыщенном растворе. Выведем эту взаимосвязь.
– характеризует концентрацию ионов осадка в насыщенном растворе. Выведем эту взаимосвязь.
Пусть растворимость осадка 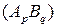 в насыщенном растворе составляет
в насыщенном растворе составляет  . Запишем уравнение диссоциации молекул осадка и выразим концентрации ионов в насыщенном растворе, обозначив растворимость
. Запишем уравнение диссоциации молекул осадка и выразим концентрации ионов в насыщенном растворе, обозначив растворимость  через
через  :
:
 (12.6)
(12.6)
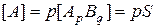 (12.7)
(12.7)
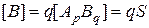 . (12.8)
. (12.8)
Составим формулу  и подставим в нее значения концентраций ионов из (12.7) и (12.8):
и подставим в нее значения концентраций ионов из (12.7) и (12.8):
 . (12.9)
. (12.9)
Из (12.9) следует, что:  (12.10)
(12.10)
Откуда:  (12.11)
(12.11)
Соотношения (12.6) и (12.10) позволяют рассчитать значение произведения растворимости по величине растворимости  и, наоборот. Зная молярную растворимость легко вычислить по формулам (12.7) и (12.9) остаточную концентрацию ионов в растворе вследствие растворимости осадка и оценить полноту осаждения. Зная молярную растворимость, легко рассчитать и растворимость по массе Р.
и, наоборот. Зная молярную растворимость легко вычислить по формулам (12.7) и (12.9) остаточную концентрацию ионов в растворе вследствие растворимости осадка и оценить полноту осаждения. Зная молярную растворимость, легко рассчитать и растворимость по массе Р.
Пример
Вычислить растворимость (г/л) осадка  и массу ионов
и массу ионов  в 100 мл насыщенного водного раствора, если
в 100 мл насыщенного водного раствора, если  .
.
Решение.
1. Обозначим молярную растворимость  через
через  .
.
2. Запишем уравнение диссоциации фосфата свинца и определим стехиометрические коэффициенты  и
и  :
:
 ;
;  ;
;  .
.
3. Выразим концентрацию ионов осадка через растворимость  :
:
 ;
;
 .
.
4. По уравнению диссоциации составим формулу ПР:  .
.
5. Подставим в формулу  концентрации ионов, выраженные через растворимость осадка:
концентрации ионов, выраженные через растворимость осадка:
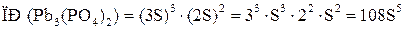 .
.
6. Выразим молярную растворимость S через ПР и найдем ее значение:
 ;
;  .
.
7. Рассчитаем растворимость  (г/л) для
(г/л) для  из соотношения:
из соотношения:
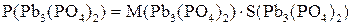 ;
;
где  – молярная масса соли;
– молярная масса соли;
 .
.
8. Найдем массу неосажденных ионов  , учитывая, что
, учитывая, что  по формуле:
по формуле:
 ;
; 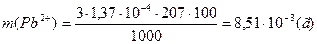
|
из
5.00
|
Обсуждение в статье: Б). Растворимость и ее виды; расчет растворимости |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

