 |
Главная |
СПИСОК ОСНОВНЫХ ФОРМУЛ ПО АНАЛИТИКЕ
|
из
5.00
|
| № п/п | название и расчетная формула |
| основные виды концентраций | |
| 1.1 | Молярная концентрация СМ(моль/л)
СМ =  или СМ = или СМ =  ν (моль) – количество вещества;V – объем раствора в мл
ν (моль) – количество вещества;V – объем раствора в мл
|
| 1.2 | Молярная концентрация эквивалента или нормальность
Сн(моль-экв/л)
Сн = 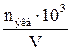 или Сн = или Сн =  nэкв (моль-экв) – количество эквивалентов вещества;
V – объем раствора в мл; Мэкв – молярная масса эквивалента
nэкв (моль-экв) – количество эквивалентов вещества;
V – объем раствора в мл; Мэкв – молярная масса эквивалента
|
| 1.3 | Простой титр Т (г/мл) Т(А) = m(А)/ V(А) V – объем раствора в мл; m(А) – масса вещества в г |
| 1.4 | Условный титр или по определяемому веществу ТВ/А ТВ/А = m(А)/ V(В) m(А) – масса вещества А в г; V(В) – объем раствора В в мл; |
| 1.5 | Процентная концентрация (массовая доля) - ω%
ω =  ; где ρ – плотность раствора; V – объем в мл
ω = ; где ρ – плотность раствора; V – объем в мл
ω = 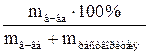 ;
ω = ;
ω =  ; где mн-ки – масса навески сухого вещества (пробы) в г. ; где mн-ки – масса навески сухого вещества (пробы) в г.
|
| 1.6 | Концентрация по массе С (г/л)
С =  ; V – объем раствора в мл ; V – объем раствора в мл
|
| формулы связи между концентрациями | |
| 2.1 | С = СМ *М; С = Сн *Мэкв; С = Т*1000 |
| 2.2 | СМ *М= Сн *Мэкв; СМ(В) = 
|
| № п/п | название и расчетная формула |
| 2.3 | Сн(В) = 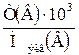 ; Сн(В) = ; Сн(В) =  ; ;
|
| 2.4 | Связь титров между собой: 
|
| 2.5 | ν = 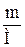 или ν = или ν =  ; или ν = ; или ν =  ; ;
|
| 2.6 | nэкв =  или nэкв = или nэкв =  ; или nэкв = ; или nэкв = 
|
| расчет молярной массы эквивалента Мэкв | |
| 3.1 | Оксиды металлов: Мэкв(оксид) =  ;
В – валентность металла; n – число атомов металла ;
В – валентность металла; n – число атомов металла
|
| 3.2 | Соли:Мэкв(соль) =  ; Мэкв(соль) = ; Мэкв(соль) =  ;
n – число протонов, замещаемых в ходе реакции ;
n – число протонов, замещаемых в ходе реакции
|
| 3.3 | Кислоты: Мэкв(кис-та) =  ; n – число протонов ; n – число протонов
|
| 3.4 | Основания:Мэкв(ос-е) =  ; n – число гидроксогрупп ; n – число гидроксогрупп
|
| 3.5 | Кислотные оксиды: Мэкв(оксид) =  ;
n – число протонов, замещаемых в ходе реакции ;
n – число протонов, замещаемых в ходе реакции
|
Формулы разведения при смешении 2-х растворов:
С1= 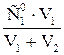 ;и С2= ;и С2=  ; где ; где  и и  - исходные концентрации растворов (С; СМ; Сн или титр Т); V1 и V2 – объемы смешиваемых растворов - исходные концентрации растворов (С; СМ; Сн или титр Т); V1 и V2 – объемы смешиваемых растворов
| |
Расчеты в прямом титровании:
расчеты основаны на законе эквивалентов в общем виде: nэкв(А) = nэкв(В), где nэкв =  или nэкв = или nэкв = 
| |
| № п/п | название и расчетная формула |
| Расчет рН в буферных растворах; рН = - log[H+]; [H+] = 10-рН | |
| 6.1 | Кислотный буфер: [H+] =  ;
где ν – количество вещества кислоты или соли в растворе; Кд – константа диссоциации (ионизации) кислоты ;
где ν – количество вещества кислоты или соли в растворе; Кд – константа диссоциации (ионизации) кислоты
|
| 6.2 | Основный буфер:[H+] =  где ν – количество вещества основания или соли в растворе; Кд – константа диссоциации (ионизации) основания; Кw – ионное произведение воды
где ν – количество вещества основания или соли в растворе; Кд – константа диссоциации (ионизации) основания; Кw – ионное произведение воды
|
| 6.3 | Вода: [H+] = [OH-] = 10-7; ионное произведение воды: Кw = 10-14 |
Редоксиметрия:
Мэкв(А) =  – расчет молярной массы эквивалента в реакциях ОВР; где n – количество моль вещества в соответствующей полуреакции; z – число электронов в данной полуреакции;
Еэкв = – расчет молярной массы эквивалента в реакциях ОВР; где n – количество моль вещества в соответствующей полуреакции; z – число электронов в данной полуреакции;
Еэкв =  – потенциал точки эквивалентности; – потенциал точки эквивалентности;  и и 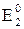 – стандартные электродные потенциалы полуреакций; z1 и z2 – число электронов в полуреакциях; – стандартные электродные потенциалы полуреакций; z1 и z2 – число электронов в полуреакциях;
| |
| 8.1 | Расчеты в гравиметрии:
ω (А) =  ; где mв(А) = F(А)*mгр.ф
F(А) – факторный множитель по веществу А; mгр.ф – масса гравиметрической формы. ; где mв(А) = F(А)*mгр.ф
F(А) – факторный множитель по веществу А; mгр.ф – масса гравиметрической формы.
|
| 8.2 | Факторный множитель (фактор пересчета)
пусть схема анализа: □ → рА → qВ;
проба определяемое гравиметрическая
вещество форма
тогда F(F) =  ; где М(А) и М(В) – малярные массы веществ;
p и q – соответствующие им стехиометрические коэффициенты связи (из схемы или уравнения реакции) ; где М(А) и М(В) – малярные массы веществ;
p и q – соответствующие им стехиометрические коэффициенты связи (из схемы или уравнения реакции)
|
| 8.3 | Формулы произведения растворимости (ПР)
ApBq (осадок) ↔ pA + qB
ПР(ApBq) = 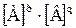 ; где А и В – ионы, образующие осадок, р и q – стехиометрические коэффициенты уравнения ; где А и В – ионы, образующие осадок, р и q – стехиометрические коэффициенты уравнения
|
| № п/п | название и расчетная формула |
| 8.4 | Расчет растворимости вещества
Молярная (моль/л): S =  ;
Растворимость по массе (г/л): Р = ;
Растворимость по массе (г/л): Р =  ;
Связь между растворимостями: Р = рSМ
где m – масса вещества или иона внасыщенном растворе; V – объем раствора в мл; р – стехиометрический множитель из уравнения диссоциации молекул осадка; для вещества осадкар = 1. ;
Связь между растворимостями: Р = рSМ
где m – масса вещества или иона внасыщенном растворе; V – объем раствора в мл; р – стехиометрический множитель из уравнения диссоциации молекул осадка; для вещества осадкар = 1.
|
| 8.5 | Расчет массы вещества или иона через растворимость:
m =  ; или m = ; или m =  где р – стехиометрический множитель из уравнения диссоциации молекул осадка; для вещества осадкар = 1; V – объем раствора в мл.
где р – стехиометрический множитель из уравнения диссоциации молекул осадка; для вещества осадкар = 1; V – объем раствора в мл.
|
| 8.6 | Расчет молярной растворимости в водном растворе через ПР:
pA + qB ↔ ApBq (осадок) – уравнение диссоциации осадка;
пусть S – растворимость осадка;
[А] = pS и [В] = qS – концентрации ионов осадка в растворе, выраженные через растворимость, тогда:
ПР(ApBq) = 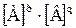 = =  = =  ;
S = ;
S = 
|
формулы для расчета рН некоторых электролитов
*n – основность кислоты или кислотность щелочи; Кw = 
| |
| 9.1 | Сильная кислота: [H+] » n×Cк-ты* |
| 9.2 | Сильное основание: [H+] » 
|
| 9.3 | Слабая кислота: [H+] = 
|
| 9.4 | Слабое основание: [H+] = 
|
| 9.5 | Соль слабой кислоты и сильного основания: [H+] = 
|
| 9.6 | Соль сильной кислоты и слабого основания: [H+] = 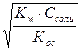
|
| 9.7 | Соль слабой кислоты и слабого основания: [H+] = 
|
Приложение 2.
|
из
5.00
|
Обсуждение в статье: СПИСОК ОСНОВНЫХ ФОРМУЛ ПО АНАЛИТИКЕ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |
Популярное:
Как построить свою речь (словесное оформление):
При подготовке публичного выступления перед оратором возникает вопрос, как лучше словесно оформить свою...
Как вы ведете себя при стрессе?: Вы можете самостоятельно управлять стрессом! Каждый из нас имеет право и возможность уменьшить его воздействие на нас...

©2015-2024 megaobuchalka.ru Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. (1368)
Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

