 |
Главная |
Tobias J. W., T. E. Schrader, G. Rocap, 5 страница
|
из
5.00
|
Элонгация и терминация трансляции у про-и эукариот во многом сходны. После образования инициаторного комплекса следующий кодон мРНК спаривается с антикодоном тРНК, несущей соответствующую аминокислоту (обозначим ее АК2). Первая аминокислота в полипептидной цепи, метионин, отщепляется от тРНК и соединяется с АК2 с помощью пептидной связи. Свободная тРНКМеt покидает рибосому. Рибосомный комплекс перемещается вдоль молекулы мРНК, и пептидил-тРНК, т. е. комплекс Ме1-АК2-тРНКАК2, занимает место, освобожденное отделившейся тРНК. Следующий кодон мРНК спаривается с соответствующим антикодоном тРНК, несущим аминокислоту АК3. АК2 отщепляется от своей тРНК и соединяется с АКЗ с помощью пептидной связи, образуя комплекс Меt-АК2-АК3-тРНКАК3. Освободившаяся от аминокислоты тРН К покидает рибосому. Рибосомный комплекс опять перемещается вдоль молекулы мРНК, и Меt-АК2-АК3-тРНКАК3 занимает вакантное место, занимаемое прежде предыдущей пептидил-тРНК. Эти события повторяются до тех пор, пока рибосома не дойдет до стоп-кодона. Антикодона, который был бы комплементарен стоп-кодону, нет ни у одной из тРНК. Однако стоп-кодон распознается неким белковым фактором освобождения; после присоединения этого фактора к рибосоме связь между последней тРНК и синтезированным полипептидом гидролизуется, тРНК, мРНК и полипептид высвобождаются, а рибосома диссоциирует на субъединицы.
Синтез мРНК и соответственно синтез белка должны строго регулироваться, поскольку у клетки недостаточно ресурсов для одновременной транскрипции и трансляции всех структурных генов. И про-, и эукариоты постоянно синтезируют только те мРНК, которые необходимы для выполнения основных клеточных функций. Экспрессия остальных структурных генов осуществляется под строгим контролем регуляторных систем, запускающих транскрипцию только в том случае, когда возникает потребность в определенном белке (белках). У прокариот транскрипция инициируется связыванием РНК-полимеразы с последовательностями ТАТА и TTGAC промоторной области структурного гена или оперона. Включение или выключение некоторых оперонов осуществляется при участии эффектора, который изменяет конформацию белка-репрессора и препятствует блокированию транскипции. При уменьшении концентрации эффектора в клетке репрессор связывается с участком ДНК, примыкающим к сайту инициации транскрипции, и препятствует перемещению РНК-полимеразы вдоль молекулы ДНК, блокируя таким образом транскрипцию. В других оперонах с участком ДНК, соседствующим с сайтом инициации траскрипции, связывается белок-активатор, который увеличивает скорость транскрипции. Связывание эффектора с активатором может снижать скорость транскрипции, ДНК-белковые взаимодействия, ответственные за регуляцию транскрипции,
ДНК,РНК и синтез белка 49
строго специфичны в отношении определенных структурных генов или оперонов. У эукариот РНК-полимераза II,которая транскрибирует структурные гены, связывается с целым набором белков — факторов транскрипции, которые последовательно присоединяются к ТАТА-последовательности промоторной области. За включение и выключение транскрипции отвечают дополнительные факторы транскрипции, которые связываются с соответствующими участками ДНК.
ЛИТЕРАТУРА
BuratowskiS. 1994. The basics of basal transcription byRNApolymerasell. Cell 77: 1-3.
Kozak M. 1991. Structural features in cukaryotic mRNAs that modulate the initiation of translation. /. Biol. Chem. 266:19867-19870.
Lodish H., D. Baltimore, A. Berk, S.L. Zipursky, P. Matsudaira, J. Darnell. 1995. Molecular Cell Biology. 3rd ed. Scientific American Books, Inc., New York, N.Y.
Nakamura Y., K. Ito, L.A. Isaksson.1996. Emerging understanding of translation termination. Cell 87: 147-150.
Schoenherr C.J., D.J. Anderson. 1995. The neuron-restrictive silencer factor (NRSF): a coordinate represser of multiple neuron-specific genes. Science267i 1360-1363.
Tate W.P., C.M. Brown.1992. Translational termination: "stop" for protein synthesis or "pause" for
regulation of gene expression. Biochemistry 31:2443-2450.
Tjian R., T. Maniatis. 1994, Transcriptional activation: a complex puzzle with few easy pieces. Cell 77: 5-8.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Опишите в общих чертах процесс репликации ДНК.
2. Чем различаются ДНК и РНК?
3. Опишите сходство и различие структурных генов про- и эукариот.
4. Опишите процесс элонгации полипептидной цепи.
5. Какова наиболее вероятная нуклеотидная последовательность, кодирующая следующую аминокислотную последовательность: MAGGTWYQLFPRKMWNDSTLHPFILPMNVAG.
6. Какой аминокислотной последовательности отвечает следующая нуклеотидная последовательность: GCGAUCGACGAUGUUUCUAAAAGUAU CUCAUCGAAAUG AGGGUUCG UAAUAGCGACCCGGGCGG.
7. Что такое ТАТА-бокс?
8. Что такое оперон? В чем заключается его биологическая роль?
9. Расскажите о трех разных способах регуляции транскрипции у прокариот.
10. Опишите основные элементы ДНК, ответственные за транскрипцию эукариотических структурных генов.
ГЛАВА 4.
Технология рекомбинантных ДНК
Технология рекомбинантных ДНК (ее называют также молекулярным клонированием или генной инженерией) — это совокупность экспериментальных процедур, позволяющая осуществлять перенос генетического материала (дезоксирибонуклеиновой кислоты, ДНК) из одного организма в другой. Никакого единого, универсального набора методик здесь не существует, но чаще всего эксперименты с рекомбинантной ДНК проводят по следующей схеме (рис. 4.1).
* Из организма — донора нужных генов — экстрагируют нативную ДНК (клонируемая ДНК, встраиваемая ДНК, ДНК-мишень, чужеродная ДНК), подвергают ее ферментативному гидролизу (расщепляют, разрезают) и соединяют (лигируют, сшивают) с другой ДНК (вектор для клонирования, клонирующий вектор) с образованием новой, рекомбинантной молекулы (конструкция «клонирующий вектор—встроенная ДНК»).
* Эту конструкцию вводят в клетку-хозяина (реципиент), где она реплицируется и передается потомкам. Этот процесс называется трансформацией.
• Идентифицируют и отбирают клетки, несущие рекомбинантную ДНК (трансформированные клетки).
• Получают специфический белковый продукт, синтезированный клетками-хозяевами, что служит подтверждением клонирования искомого гена.
Предпосылками к созданию технологии рекомбинантных ДНК послужили многие открытия в области молекулярной биологии, энзимологии нуклеиновых кислот и молекулярной генетики бактериальных вирусов и внехромосомных элементов бактерий (плазмид). Конструирование рекомбинантных молекул осуществляется с помощью целого арсенала ферментов — обязательного и незаменимого инструмента практически всех этапов этого сложнейшего процесса. Речь идет прежде всего о ферментах рестрикции (рестрицирующих эндонуклеазах, рестриктазах), которые узнают и расщепляют специфические нуклеотидные последовательности в двухцепочечной молекуле ДНК.
Рестрицирующие эндонуклеазы
При молекулярном клонировании важно, чтобы расщепление донорной и векторной ДНК происходило в строго определенных участках (сайтах) с образованием дискретного и воспроизводимого набора фрагментов. Если пропустить хромосомную ДНК через шприц с иглой малого диаметра или обработать ее ультразвуком, то мы получим фрагменты длиной от 0,3 до 5 т.п.н. К сожалению, в ходе этих простых операций разрывы двухцепочечных молекул происходят случайным образом, так что при каждой обработке препарата ДНК получается совершенно новый набор фрагментов. Молекулярное клонирование стало возможным только после выделения высокоспецифичных бактериальных ферментов, которые узнают определенные последовательности оснований в двухцепочечной молекуле ДНК и расщепляют обе цепи. Эти ферменты называются рестрицирующими эндонуклеазами типа II.
Одна из первых рестрицирующих эндонуклеаз типа II была выделена из бактерии Escherichia coli
Технология рекомбинантных ДНК 51
 Рис. 4.1. Клонирование рекомбинантной ДНК. Донорную ДНК расщепляют рестрицирующей эндонуклеазой и встраивают в клонирующий вектор. Полученную конструкцию вводят в популяцию клеток-хозяев, идентифицируют те клетки, которые содержат рекомбинантную ДНК, и культивируют их. При необходимости можно индуцировать экспрессию клонированного гена в клетках-хозяевах и получить кодируемый белок
Рис. 4.1. Клонирование рекомбинантной ДНК. Донорную ДНК расщепляют рестрицирующей эндонуклеазой и встраивают в клонирующий вектор. Полученную конструкцию вводят в популяцию клеток-хозяев, идентифицируют те клетки, которые содержат рекомбинантную ДНК, и культивируют их. При необходимости можно индуцировать экспрессию клонированного гена в клетках-хозяевах и получить кодируемый белок
| 
|
52ГЛАВА 4
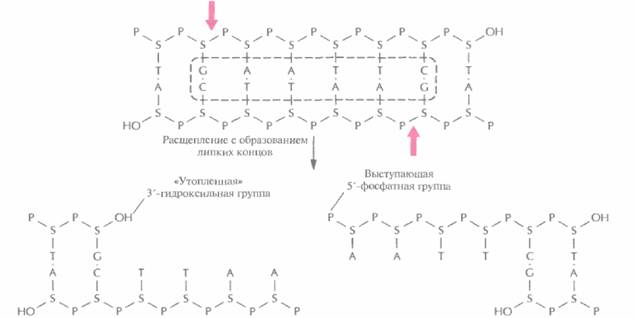
| |
| Риc. 4.2. Расщепление короткого фрагмента ДНК рестрицирующей эндонуклеазой типа II EcoRI с образованием липких концов. Стрелки — связи, по которым происходит расшепление в сахарофосфатном остове. S — деэоксирибоза, P — фосфатная группа, ОН — гидроксильная группа. Последовательность, распознаваемая EcoRI, выделена штриховой линией. | |

| |
| Рис. 4.3. Расщепление короткого фрагмента ДНК рестриктазой типа II HindIIс образованием тупых концов. Стрелки — связи, по которым происходит расщепление в сахарофосфатном остове. Буквенные обозначения - те же, что и на рис, 4.2. Последовательность, распознаваемая рестрикгазой HindII, выделена штриховой линией. |
Технология рекомбинантных ДНК 53
и получила назваие EcoRI. Этот фермент узнает участок ДНК, содержащий специфическую палиндромную последовательность (последовательность-перевертыш, идентичную в обеих цепях при прочтении в направлении 5'-->3') из шести пар оснований и вносит разрыв между остатками гуанина и аденина в каждой цепи (рис. 4.2), расщепляя связь между атомом кислорода при 3'-атоме углерода сахарного остатка одного нуклеотида и фосфатной группой, присоединенной к 5 '-углеродному атому сахарного остатка соседнего нуклеотида. Разрывы в цепи ДНК располагаются наискось друг от друга, в результате чего образуются одноцепочечные комплементарные концы с «хвостами» из четырех нуклеотидов в каждом (липкие концы). Каждый одноцепочечный «хвост» заканчивается 5'-фосфатной группой, а 3'-гидроксильная группа противоположной цепи как бы утоплена.
Помимо EcoRI, из бактериальных клеток были получены сотни рестрицирующих эндуклеаз типа II. Названия этим эндонуклеазам даются по такому же принципу, как и .EcoRI: род микроорганизма обозначается прописной буквой, а вид — двумя строчными; штамм обычно не указывается. Римские цифры — порядковый номер данной эндонуклеазы в ряду прочих рестриктаз, выделенных из данного микроорганизма. Например, HраIи НраII — это соответственно первая и вторая рестрицируюшие эндонуклеазы типа II, выделенные из Haemophilus parainfluenzae.
Палиндромные последовательности, которые распознаются рестрицирующими эндонуклеазами типа II и в которых происходит расщепление молекулы ДНК, называются сайтами узнавания. Помимо рестриктаз, гидролизующих (расщепляющих) полинуклеотидную цепь с образованием липких концов, существуют рестриктазы, которые вносят разрывы в цепи строго друг против друга с образованием фрагментов ДНК с «тупыми» концами (рис. 4.3). Сайты узнавания могут состоять из четырех, пяти, шести, восьми или более пар нуклеотидов (табл. 4.1). От длины сайта узнавания зависит частота его распространения в молекуле ДНК; в большинстве случаев используют рестриктазы, узнающие тетра- и гексануклеотиды.
Рестрицирующие эндонуклеазы типа II играют ключевую роль при генном клонировании.
| Таблица 4.1. Нуклеотидные последовательности, распознаваемые некоторыми ферментами рестрикции | ||
| Фермент | Сайт узнавания | Характер образуемых концов |

| 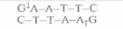
| 
|

| 
| 
|

| 
| 
|

| 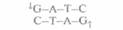
| 
|

| 
| 
|

| 
| 
|

| 
| 
|

| 
| 
|
Обработка образца ДНК определенной рестриктазой всегда дает один и тот же набор фрагментов — при условии, что расщепление происходит по всем сайтам узнавания. Если использовать несколько ферментов рестрикции и сначала обработать ДНК каждой из рестриктаз в отдельности, а затем их комбинациями, можно построить физическую карту данной ДНК, т. е. установить порядок следования сайтов рестрикции вдоль молекулы. Определив размер полученных фрагментов с помощью гель-электрофореза, можно найти положение рестрикционных сайтов (дополнение 4.1). На рис. 4.4,А указаны размеры фрагментов, полученных в результате расщепления ДНК разными рестриктазами и их смесью. Из этих данных следует, что данный участок ДНК имеет по два сайта для BamHIи EcoRI.
Чтобы построить рестрикционную карту, следует сравнить размеры фрагментов, полученных при раздельной рестрикции и при рестрикции смесью ферментов. Результат такого сравнения представлен на рис. 4.4,Б. Если при гидролизе ДНК каждой из двух рестриктаз (EcoRI и ВатHI) образуются три фрагмента, значит, в исходном фрагменте ДНК было два сайта узнавания для каждой из использованных рестриктаз. Фрагмент размером 300 п. н,, который образуется в результате гидролиза EcoRI, не расщепляется
54ГЛАВА 4
при гидролизе смесью ЕсоRIи ВатHIв отличие от ЕсоRI-фрагментов размером 850 и 500 п. н. Значит, два EcoRI-сайта находятся на расстоянии 300 п. н. друг от друга и между ними нет ВатHI-сайта, а в ЕсоRI-фрагментах длиной 850 и 500 п.н. есть по одному ВатHI-сайту. Фрагмент размером 950 п. н., который образуется при обработке ДНК рестриктазой ВатHI, при двойном гидролизе расщепляется EcoRI на три фрагмента (250+3004400 - 950 п.н.). Значит, два ВатHI-сайта находятся на расстоянии 250 и 400 п. н. по разные стороны от сайтов для EcoRI. ВатHIрасщепляет EcoRI-фрагмент длиной 850 п. н. на фрагменты длиной 250 и 600 п, н., а один из сайтов для EcoRl находится на расстоянии 250 п. н. от сайта для ВатHI, значит, фрагмент 600 п. н.
| ДОПОЛНЕНИЕ 4.1 | ||
| Гель-электрофорез Для разделения белков и нуклеиновых кислот широко применяется метод гель-электрофореза. Его принцип заключается в следующем. Исследуемый препарат (раствор белка, ДНК или РНК) вносят в лунку, расположенную у края геля - полужидкой среды с сетчатой пространственной структурой (обычно для электрофореза используют тонкие пластины геля). Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, и когда через гель пропускают электрический ток, они перемещаются в электрическом поле. Молекулы одинакового размера (и одинакового заряда) движутся единым фронтом, образуя в геле дискретные невидимые полосы. Чем меньше размер молекул, тем быстрее они движутся. Постепенно исходный препарат, состоящий из разных макромолекул, разделяется на зоны, распределенные по длине пластинки. За ходом электрофореза следят по перемещению в геле красителя -заряженного низкомолекулярного вещества, которое вносят в каждую лунку перед началом электрофореза. Когда краситель достигает конца пластины, электрофорез останавливают, а гель окрашивают красителем, прочно связывающимся с белками или нуклеиновыми кислотами. Если образец представляет собой дискретный набор макромолекул разного размера, то после электрофореза получается набор четких полос, рас- | положенных одна под другой. Если же распределение молекул по размеру более или менее непрерывно, то получается смазанная картина. По интенсивности окраски полос можно судить о концентрации макромолекул в образце. Чтобы определить относительную молекулярную массу разделенных фрагментов, одновременно проводят электрофорез маркерных макромолекул с известными молекулярными массами. Набор маркеров должен охватывать весь диапазон молекулярных масс в данной системе. Образец маркерных молекул вносят в отдельную лунку, расположенную вблизи одного из краев пластинки (или в две лунки у двух разных краев). Логарифм относительной молекулярной массы маркера линейно связан с его электрофоретической подвижностью Rf — величиной, равной отношению расстояний, пройденных маркерной молекулой и красителем (фронтом растворителя). Построив график зависимости логарифма относительных молекулярных масс маркеров от Rf, можно найти относительную молекулярную массу каждого компонента образца. Относительная мол. масса белков измеряется в дальтонах, двухцепочечных нуклеиновых кислот - в числе пар нуклеотидов, одноцепочечных — в числе нуклеотидов. Для разделения белков обычно используют полиакриламидный гель (ПААГ), Он образуется при сополимеризации акрилами- | да и бисакриламида, использующегося в качестве сшивки линейных полимеров акриламида. Размер ячеек в полиакриламидной «сетке» зависит от концентрации акриламида и соотношения между количеством акриламида и бисакриламида. Белок перед электрофорезом часто обрабатывают анионным детергентом додецилсульфатом натрия (ДСН), что позволяет проводить фракционирование в зависимости только от одного параметра — молекулярной массы, а зависимость от конформации, плотности упаковки полипептидной цепи и др. исключается. Электрофорез в ПААГ-ДСН позволяет разделять белки с мол. массой от 20 до 200 кДа. Для электрофоретического разделения нуклеиновых кислот среднего размера обычно применяют агарозные гели. Агароза -это особо чистая фракция, получаемая из агара или непосредственно из агарообразующих морских водорослей. В 1,0% агарозном геле можно разделять молекулы ДНК размером от 600 до 20 000 п. н. Для фракционирования более крупных молекул ДНК (миллионы пар оснований), денатурированной ДНК и РНК приходится использовать специальные системы электрофореза. Иногда для решения специальных задач для разделения ДНК применяют поли акриламидные гели. Так, в 20% полиакриламидном геле можно разделить фрагменты ДНК, состоящие всего из шести оснований и различающиеся лишь одним нуклеотидом. |
Технология рекомбинантных ДНК 55
| Рис. 4.4. Картирование сайтов рестрикции. А. Результаты гель-электрофореза фрагментов ДНК, полученных ее расщеплением указанными ферментами. Очищенную ДНК гидролизовали рестриктазами EcoRIи BamHIраздельно, а затем их смесью, проводили гель-электрофорез и визуализировали продукты окрашиванием бромистым этидием. Числа слева от горизонтальных полос -длина фрагментов в парах оснований. Б. Рестрикционная карта, построенная по электрофоретическим данным. Числа — расстояние между сайтами узнавания соответствующих ферментов. | 
|
должен содержать один из концов исходной молекулы ДНК. Далее, мы видим, что ВатHIрасщепляет ЕсоRI-фрагмент длиной 500 п. н. на два фрагмента размером 100 и 400 п. н. и что один из EcoRI-сайтов отделен от BamHI-caйтa 400 п. н.; значит, фрагмент длиной 100 п. н, должен содержать другой конец исходной молекулы. Карта на рис. 4.4,Б иллюстрирует четкое соответствие между положением сайтов рестрикции и размерами фрагментов, получающихся при каждом гидролизе.
Расщепление рестрицирующими эндонуклеазами имеет еще одно применение. Когда два разных образца ДНК обрабатывают одной и той же рестриктазой с образованием фрагментов с липкими концами, а затем смешивают эти образцы, то благодаря комплементарному спариванию липких концов фрагментов разных образцов могут образовываться новые комбинации генов -рекомбинантные ДНК (рис, 4.5).
Для осуществления молекулярного клонирования недостаточно одних только ферментов рестрикции. Во-первых, водородные связи между теми четырьмя основаниями, которые образуют липкие концы, недостаточно прочны, чтобы удержать два объединившихся фрагмента ДНК, Необходим какой-то инструмент для устранения разрыва в сахарофосфатном остове молекyлы, т. е. для восстановления связи между 3'-гидроксильной концевой группой одной цепи и 5'-фосфатной группой другой. Таким инструментом является ДНК-лигаза бактериофага Т4. Этот фермент катализирует образование фосфодиэфирных связей между концами полинуклеотидных цепей, которые уже удерживаются вместе благодаря спариванию липких концов. Кроме того, ДНК-лигаза Т4 «сшивает» тупые концы, которые сближаются друг с другом после того, как объединяемые фрагменты связываются с ферментом (рис. 4,6). Во-вторых, объеди-
56 ГЛАВА 4

|
| Рис. 4.5, Отжиг комплементарных липких концов фрагментов, образующихся при расщеплении двух разных образцов ДНК рестрицирующей эндонуклеазой BатHI. Четыре фрагмента, представленных на рисунке, могут соединиться друг с другом с образованием шести разных молекул ДНК (на рисунке показаны не все возможные комбинации). Фрагменты удерживаются вместе водородными связями, образующимися между четырьмя основаниями липких концов, но эти связи недостаточно прочны, чтобы молекулы в растворе оставались стабильными длительное время. |
нение разных молекул ДНК само по себе бесполезно, если вновь образованные комбинации (рекомбинантные ДНК) не будут реплицироваться в клетке-хозяине. Таким образом, если одна часть рекомбинантной молекулы ДНК несет нужный ген, который предполагается клонировать, то другая должна содержать информацию, необходимую для репликации в клетке рекомбинантной ДНК. Чтобы решить эту проблему, используют клонирующие векторы. В-третьих, при рестрикции ДНК образуется смесь разнообразных фрагментов, и после их лигирования с векторной ДНК образуется множество различных комбинаций. Необходимо уметь распознавать те реципиентные клетки, которые содержат ДНК с нужной нуклеотидной последовательностью. Для этого используют различные системы скрининга.
Плазмидные векторы
Плазмиды -- это внехромосомные автономно реплицирующиеся цвухцепочечные кольцевые молекулы ДНК. Плазмиды есть практически у
Технология рекомбинантных ДНК 57
| Рис. 4.6. ДНК-лигаза Т4 образует фосфодиэфирные связи между 5'-фосфатными и 3'-гидроксилъными группами в месте разрыва в остове двухцепочечнои ДНК. А. Лигирование липких концов, Б. Нитрование тупых концов. | 
|
всех бактерий. Одни из них содержат информацию, обеспечивающую их собственный перенос из одной клетки в другую (F-плазмиды), другие несут гены устойчивости к антибиотикам (R-плазмиды) или специфические наборы генов, ответственных за утилизацию необычных метаболитов (плазмиды деградации). Есть плазмиды, в которых не обнаружены гены, выполняющие какие-то определенные функции (критические плазмиды; от англ, cryptic — скрытый, латентный). Размеры плазмид варьируют от менее 1 до более 500 т.п.н. Каждая из них содержит сайт начала репликации (ori), без которого репликация плазмиды в клетке-хозяине была бы невозможна.
Некоторые плазмиды представлены в клетке 10—100 копиями; они называются высококопийными. Низкокопийные плазмиды присутствуют в клетке в числе 1—4 копий. На долю плазмидной ДНК обычно приходится 0,1—5,0% суммарной клеточной ДНК. Если две или более плазмиды не могут сосуществовать в одной и той же клетке, то говорят, что они принадлежат к одной группе несовместимости. Плазмиды, относящиеся к разным группам несовместимости, беспрепятственно существуют в одной клетке, независимо от числа копий. У некоторых микроорганизмов в одной клетке было обнаружено до 8—10 разных плазмид, при этом каждая из них выполняла свои функции, была представлена характерным для нее числом копий и относилась к своей собственной группе несовместимости. Одни плазмиды несут специфичный сайт инициации репликации и могут реплицироваться только в клетках одного вида. У других плазмид этот сайт менее специфичен, и они реплицируются в самых разных бактериальных клетках. Соответственно различают плазмиды с узким и с широким спектром хозяев.
Как автономно реплицирующиеся генетические элементы плазмиды обладают всеми основными свойствами, которые позволяют использовать их в качестве вектора для переноса клонируемой ДНК. Но довольно часто природные (немодифицированные, несконструированные) плазмиды бывают лишены некоторых обязательных для «высококачественного" вектора свойств. К таким важным свойствам относятся: 1 ) небольшой размер, поскольку эффективность переноса экзогенной ДНК в Е. coli значительно снижается при длине плазмиды более 15 т. п. н.; 2) наличие уникального сайта рестрикции, в который может быть осуществлена вставка; 3) наличие одного или более селективных генетиче-
58 ГЛАВА 4
ских маркеров для идентификации реципиентных клеток, несущих рекомбинантную ДНК. Поэтому плазмидные векторы приходится создавать с помощью генной инженерии.
Плазмидный вектор pBR322
В 80-е годы плазмидный вектор pBR322 был одним из самых популярных универсальных векторов. Обычно обозначение плазмидного вектора включает строчную букву p (от англ, plasmid) и еще несколько букв, имеющих отношение к описанию вектора или к истории его создания. Так, буквы BR в обозначении плазмиды pBR322 указывают на авторство Ф. Боливара и Р. Родригеса, сконструировавших эту плазмиду, а число 322 — цифровое обозначение, взятое из их исследовательских протоколов. Длина плазмиды pBR322 — 4361 п. н. Она несет два гена устойчивости к антибиотикам (рис. 4.7), ампициллину (Ampr) и тетрациклину (Tetr), a также уникальные сайты для BamHI, HindIIIи SalIв генеТеtr, один PstI-сайт в гене Аmрr, один сайт для EcoRI, находящийся за пределами кодирующих последовательностей, и сигнал начала репликации, обеспечивающий репликацию исключительно в E. coli. Плазмида реплицируется с образованием большого числа копий, в другие бактериальные клетки переносится с трудом.
Как работает клонирующий вектор pBR322? Если очищенную кольцевую плазмиду pBR322

|
| Рис. 4.7. Генетическая карта плазмидного вектора pBR322. Гены устойчивости к тетрациклину (Tetr) и ампициллину (Аmрr) содержат уникальные сайты узнавания для HindIII, SalI, BamHI и PstI. EcoRI-сайт расположен вне этих генов. Длина вектора — 4361 п. н. |
обработать рестриктазой, расщепляющей ее в единственном сайте, расположенном в одном из генов устойчивости к тому или другому антибиотику, то образуется линейная молекула с липкими концами. Такие молекулы смешивают с донорной ДНК, содержащей нужный ген и предварительно обработанной такой же рестриктазой. Поскольку липкие концы этих двух ДНК взаимно комплементарны, они спариваются с образованием гибридных молекул. Далее смесь обрабатывают ДНК-лигазой фага Т4 в присутствии АТР, в результате чего образуется множество разных комбинаций фрагментов, а также нежелательные продукты, в частности объединившиеся между собой фрагменты до-норной ДНК и исходные плазмидные ДНК, Чтобы уменьшить количество последних, обрабатывают рестрицированную плазмидную ДНК щелочной фосфатазой, отщепляющей от линеаризованной молекулы 5'-фосфатные группы: ДНК-лигаза не может сшить концы дефосфорилированной линейной плазмидной ДНК (рис. 4.8). Что касается собственно рекомби-нантных молекул ДНК, то хотя в них и имеются два одноцепочечных разрыва, ее фрагменты удерживаются вместе двумя фосфодиэфирными связями, образовавшимися с помощью ДНК-лигазы между дефосфорилированной плазмидной ДНК и рестрицированной донорной ДНК (рис. 4,8). После репликации в трансформированной клетке одноцепочечные разрывы устраняются системой лигирования клетки-хозяина.
|
из
5.00
|
Обсуждение в статье: Tobias J. W., T. E. Schrader, G. Rocap, 5 страница |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

