 |
Главная |
Tobias J. W., T. E. Schrader, G. Rocap, 7 страница
|
из
5.00
|
торые несутполноразмерную нуклеотиднуюпоследовательность, кодирующую белок-мишень.
Векторы для клонирования крупных фрагментов ДНК
Векторы на основе бактериофага λ
С помощью плазмидных векторов можно клонировать фрагменты ДНК длиной до 10 т. п. н. Однако при создании геномных библиотек часто приходится работать с более крупными фрагментами. Для этого были разработаны векторы на основе бактериофага λ Ε. coli.
После проникновения фага λ в клетку E. coli события могут развиваться по двум сценариям. Если реализуется литический цикл, то фаг начинает интенсивно размножаться и примерно через 20 мин клетка разрушается (лизирует) с высвобождением до 100 новых фаговых частиц. При альтернативном варианте развития событий фаговая
72 ГЛАВА 4
ДНК включается в хромосому Е. coli как профаг и реплицируется в клетке вместе с нормальными бактериальными генами (состояние лизогении). Однако при недостатке питательных веществ или иных неблагоприятных обстоятельствах интегрированная фаговая ДНК высвобождается, и запускается литический цикл развитии. Размер ДНК фага λ составляет примерно 50 т. п. н., причем значительная ее часть (около 20 т. п. н.) несущественна для размножения фага и отвечает за его встраивание в хозяйскую ДНК. В связи с этим возникла идея, что ее можно заменить фрагментом другой ДНК эквивалентного размера. Образующаяся ре-комбинантная молекула будет реплицироваться в клетке как ДНК «рекомбинантного" фага λ, «вставшего" на литический путь развития.
Чтобы понять, как функционирует векторная система на основе фага λ, необходимо рассмотреть молекулярные аспекты литического цикла развития. Инфекционная фаговая частица имеет головку, в которой заключена плотно упакованная ДНК длиной примерно 50 т. п. н., и отросток с отходящими от него тонкими белковыми нитями (фибриллами). Сборка головки и отростка и упаковка ДНК четко скоординированы. ДНК фага λ — это линейная двухцепочечная молекула длиной 50 т. п. н. с одноцепочечными 5'-«хвостами» из 12 нуклеотидов. Их называют липкими (cos) концами, поскольку они взаимно комплементарны и могут спариваться друг с другом. После того как фаговая ДНК проходит через отросток и попадает в E. coli, cos-концы соединяются с образованием кольцевой молекулы. На раннем этапе литического цикла в результате репликации кольцевой молекулы ДНК образуется линейная молекула, состоящая из нескольких сегментов длиной 50 т. п. н. (рис. 4.16, A). Каждый из таких сегментов упаковывается в белковую головку, к последней присоединяется уже собранный отросток и образуется новая фаговая частица (рис. 4.16,Б). При упаковке молекулы ДНК длиной менее 38 т. п. н. получается неинфекционная фаговая частица, а фрагменты длиной более 52 т, п. н. не умещаются в головку. Сегменты длиной 50 т. п. н. в линейной молекуле ДНК разделены cos-сайтами, и именно по этим сайтам разрезается молекула, когда очередной сегмент заполняет головку. Разрезание осуществляет фермент, находящийся у входа в головку.
В результате исследований по изучению сборки фага λ была разработана система упаковки молекул ДНК in vitro с образованием инфекционных фаговых частиц. Смешав в пробирке очищенные пустые головки, фаговую ДНК и собранные отростки, можно получить инфекционные фаговые частицы.
Один из множества λ-векторов для клонирования имеет два BamHI-сайта, фланкирующих участок длиной 20 т. п. н. При гидролизе очищенной фаговой ДНК рестриктазой ВатНIобразует-

|
| Рис. 4.16. Литический путь развития бактериофага λ. А. При репликации кольцевой ДНК. бактериофага λ образуется линейная молекула, состоящая из повторяющихся сегментов длиной примерно 50 т. п. н. Каждый из этих сегментов представляет собой полноразмерную фаговую ДНК. Б, Фаговая головка вмещает один такой сегмент, затем к головке присоединяется уже собранный отросток. |
Технологиярекомбинантных ДНК 73

|
| Рис, 4.17. Клонирующая система на основе бактериофага λ. Фаговая ДНК имеет два BamHI-сайта, фланкирующих ее I/Е-сегмент. Клонируемую ДНК расщепляют с помощью BamHI, фракционируют полученные фрагменты по размеру и выделяют те из них, которые имеют размер от 15 до 20 т.п.н. Фаговую ДНК обрабатывают этим же ферментом. Оба препарата ДНК смешивают и обрабатывают ДНК-лигазой фага Т4. Лигированная смесь содержит самые разные комбинации ДНК, в том числе 1) восстановленную ДНК фага λ и 2) рекомбинантные молекулы, содержащие R- и L-области фаговой ДНК и вставку клонируемой ДНК размером ~20 т. п. н, занявшую место области I/Е фагового генома. Рекомбинантные молекулы упаковывают в головки бактериофага λ in vitro, и после добавления отростков получают инфекционные фаговые частицы. В инфицированных рекомбинантным фагом клетках Е. соli, в хромосому которых интегрирована ДНК бактериофага Р2, могут реплицироваться и образовывать инфекционные частицы только молекулы ДНК, составленные из R- и L-областей фаговой ДНК и клонированной вставки размером ~20 т.п.н. |
74ГЛАВА 4
ся три фрагмента. Так называемое левое плечо (область L) содержит генетическую информацию о головке и отростке фага, правое плечо (область R) ведает репликацией ДНК и лизисом, а средний сегмент имеет гены, ответственные за процессы интеграции и исключения (сегмент I/E, от англ. integration/excision). Задача исследователя состоит в том, чтобы заменить этот центральный участок нуклеотидной последовательностью длиной примерно 20 т. п. н. (рис. 4.17) нужной ДНК. ДНК, предназначенную для клонирования, тоже расщепляют с помощью ВатHIи выделяют фрагменты размером от 15 до 20 т. п. н. Оба препарата — фаговую и чужеродную ДНК — объединяют и добавляют ДНК-лигазу фага Т4, а затем — пустые головки и уже собранные отростки. Фрагменты ДНК длиной 50 т. п. н. упаковываются в головки, к ним присоединяются отростки и образуются инфекционные фаговые частицы. Фрагменты большего (>52 т. п. н.) или меньшего (<38 т. п. н.) размера упаковываться не могут. Рекомбинантный фаг λ может размножаться только в тех штаммах E. coli, которые не обеспечивают размножения фага λ с интактной областью I/Е. Для сохранения рекомбинантного фага λ его периодически пересевают на свежую культуру E. coli.
Для скрининга библиотек на основе фага λ можно использовать ДНК-зонды или иммунологические методы. Зоны лизиса (бляшки) переносят на фильтр и соответствующим образом тестируют. Если используется ДНК-гибридизация, то вначале удаляют фаговые белки, затем ДНК денатурируют и фиксируют на фильтре. При тестировании иммунологическим методом белки, кодируемые клонированными генами, переносят и фиксируют на фильтре вместе с бляшкой. Сопоставив пятна на фильтре, дающие положительную реакцию, с бляшками на исходной чашке, отбирают позитивные бляшки и проводят субкультивирование. Субкультуры служат источником рекомбинантных бактериофагов, которые можно по отдельности культивировать в E, coli.
Космиды
Векторы, называемые космидами, могут включать до 40 т. п. н. чужеродной ДНК и при этом активно амплифицироваться в E. coli как плазмиды. Космиды объединяют в себе свойства плазмидных векторов и векторов на основе фaгa λ. Например, широко применяемая космида pLFR-5 (приблизительно 6 т. п. н.) имеет два cos-сайта фага λ, разделенных сайтом рестрикции для ScaI, полилинкер с шестью уникальными сайтами рестрикции (HindIII, PstI, SalI, BamHI, SmaI и EcoRI), точку начала репликации ДН К (ori) и ген устойчивости к тетрациклину (Tetr). Эта космида может интегрировать чужеродную ДНК длиной до 40 т. п. н. (рис. 4.18). Предназначенные для клонирования фрагменты ДНК длиной около 40 т. п. н. очищают центрифугированием в градиенте плотности сахарозы от продуктов частичного гидролиза донорной ДНК рестриктазой BamHI (рис. 4.18), a pLFR-5 сначала подвергают гидролизу с помощью ScaI, а затем ВатHI. Препараты ДНК смешивают и лигируют. Те продукты лигирования, которые содержат вставку длиной 40 т. п. н., имеют суммарный размер, близкий к 50 т. п. н., и следовательно, могут упаковываться in vitro в головки фага λ. Реассоциировавшие молекулы pLFR-5,
Рис. 4.18.Клонирование с помощью космидного вектора. Космида имеет точку начала репликации (ori), обеспечивающую ее существование в Е. coli в виде плазмиды; два интактных cos-конца, разделенных уникальным сайтом для ScaI: BamHI-сайт вблизи одного из cos-сайтов и ген устойчивости к тетрациклину (Tetr). ДНК, которую хотят клонировать, расщепляют рестриктазой ВатHIи фракционируют по размеру, чтобы выделить молекулы длиной примерно 40 т. п. н. Плазммдную ДНК. расщепляют с помощью ScaIи ΒαmIII. Оба препарата ДНК смешивают и обрабатывают ДНК-лигазой фага Т4. Некоторые из гибридных молекул, образовавшихся после лигирования, содержат вставку размером около 40 т. п. н., так что их суммарная длина составляет примерно 50 т. п. н. Эти молекулы упаковываются in vitro в головки бактериофага λ, затем к головкам прикрепляются отростки, и образуются инфекционные частицы. При инфицировании этим «фагом» E. coli в бактериальной клетке оказывается линейная молекула ДНК с cos-концами, которые спариваются друг с другом. ДНК-лигаза клетки-хозяина зашивает одноцепочечные разрывы, и образовавшаяся кольцевая молекула существует в клетке-хозяине как автономно реплицирующаяся единица. Трансформированные клетки можно идентифицировать по признаку устойчивости к тетрациклину.
ТехнологиярекомбинантныхДНК 75

|
76ГЛАВА 4
не содержащие вставок, упакованы не будут. После сборки фаговых частиц инфицируют ими Е. coli (рис. 4.18).
Оказавшись в бактериальной клетке, линейная молекула pLFR-5 со вставкой замыкается в кольцо благодаря спариванию cos-сайтов. В такой стабильной конфигурации она может долгое время существовать в клетке и реплицироваться как гибридная плазмида, поскольку содержит все необходимые для этого элементы. Более того, ген устойчивости к тетрациклину обеспечивает рост колоний, несущих данную космиду, на среде с этим антибиотиком; нетрансформированные клетки при этом погибают. Существуют и другие космидные векторы на основе фага λ.
Космиды имеют большое преимущество по сравнению с плазмидами: в них можно встраивать более протяженные фрагменты ДНК, а это означает, что для создания геномной библиотеки нужно меньшее число клонов и потребуется меньше времени на их скрининг.
Векторные системы для клонирования очень крупных фрагментов ДНК
Векторные системы, способные интегрировать крупные вставки (>100т. п. н.), имеют большую ценность при анализе сложных эукариотических геномов. Без таких векторов не обойтись, например, при картировании генома человека или при идентификации отдельных генов. В отличие от библиотек с небольшими вставками, в геномной библиотеке с крупными вставками скорее всего будет представлен весь генетический материал организма. Кроме того, в этом случае уменьшается число клонов, которые нужно поддерживать, и увеличивается вероятность того, что каждый из генов будет присутствовать в «своем» клоне. Для клонирования фрагментов ДНК размером от 100 до 300 т. п. н. был сконструирован низкокопийный плазмидный вектор на основе бактериофага Р1 — химерная конструкция, называемая искусственной хромосомой на основе фага Р1. Был создан также очень стабильный вектор, способный интегрировать вставки длиной от 150 до 300 т. п. н., на основе F-плазмиды (F-фактора, или фактора фертильности) Е. coli, которая представлена в клетке одной или двумя копиями, с селекционной системой lacZ' векторов pUC. Эта конструкция называется бактериальной искусственной хромосомой (ВАС, от англ, bacterial artificial chromosomes).
Генетическая трансформация прокариот
Перенос ДНК в E. coli
Трансформация — это процесс введения свободной ДНК в бактериальную клетку. E. coli используется в качестве организма-хозяина при работе со многими рекомбинантными ДНК, и чтобы обеспечить проникновение в клетки плазмидной ДНК, их обрабатывают ледяным раствором СаС12, а затем выдерживают при 42 °С в течение 1,5 мин. По-видимому, в результате такой обработки происходит локальное разрушение клеточной стенки. Этот метод дает максимальную частоту трансформации, примерно 10—3, т. е. на каждую 1000 клеток приходится одна трансформированная. Эффективность трансформации, которая определяется как число трансформантов на 1 мкг добавленной ДНК, составляет примерно 107—10К. Частота трансформации никогда не бывает 100-процентной, но этот недостаток компенсируется применением схем отбора, позволяющих быстро идентифицировать трансформированные клетки.
Клетки, способные поглощать чужеродную ДНК, называются компетентными. Компетентность E. coli необходимо индуцировать, а некоторые другие бактерии обладают этим свойством изначально. Долю компетентных клеток можно повысить, используя специальную питательную среду или условия культивирования. Для бактерий, устойчивых к химическим индукторам компетентности или не обладающих природной компетентностью, применяются другие системы доставки ДНК.
Электропорация
Для увеличения проницаемости клеточных мембран на них воздействуют электрическим током. Эта процедура называется электропорацией. Условия ее проведения различаются для разных видов бактерий. При работе с Е. сой клеточную суспензию (~50 мкл) и ДНК помещают в сосуд с погруженными в него электродами и подают единичный импульс тока длительностью ~4,5 мс (емкость конденсатора 25 мкФ,
Технология рекомбинантных ДНК 77
напряжение 2,5 кВ, сопротивление 200 Ом). После такой обработки эффективность трансформации повышается до 109 для коротких плазмид (примерно 3 т. п. н.) и до 106 для больших (примерно 135 т. п. н.). Аналогичные условия можно использовать для введения в Е. соli вектора ВАС. Таким образом, электропорация является эффективным методом трансформации Е. соli плазмидами, содержащими вставки длиннее 100 т. п. н. Есть основания полагать, что подходящие условия электропорации будут разработаны для всех видов бактерий, так что эта процедура может стать стандартным методом трансформации.
О механизме проникновения в клетку ДНК в процессе электропорации известно очень мало. По-видимому, как и при химически индуцированной трансформации, в результате электрошока в клеточной стенке образуются временные поры, через которые ДНК и проходит в клетку.
Конъюгация
Рекомбинантная ДНК проникает в клетки бактерий, характеризующихся низкой частотой трансформации, таким же образом, как плазмидная ДНК из донорской клетки в реципиентную в естественных условиях. Некоторые плазмиды обладают способностью создавать межклеточные контакты, через которые они и переходят из одной клетки в другую. Образование контактов между донорной и реципиентной клетками обеспечивается конъюгативными свойствами плазмид, а сам перенос ДНК — мобилизационными. Большинство плазммд, которые используются в работах с рекомбинантными ДНК, не обладают конъюгативными функциями и поэтому не могут переходить в ре-ципиентные клетки путем конъюгации. Однако проникновение в клетку некоторых плазмидных векторов все-таки происходит при наличии в этой клетке второй плазмиды, обладающей конъюгативными свойствами. Таким образом, введя в клетку, несущую мобилизуемый плазмидный вектор, плазм иду с конъюгативными функциями, можно трансформировать клетки-реципиенты, с трудом поддающиеся трансформации другими способами.
Опишем в общих чертах используемую для этого стандартную экспериментальную процедуру. Смешивают клетки трех разных штаммов. Когда клетки оказываются в непосредственной близости друг от друга, конъюгативная плазми-да, которая в данном случае обладает также мобилизационными свойствами, сама переходит в клетку, содержащую мобилизуемый плазмидный вектор, а затем обеспечивает перенос векторной ДНК в реципиентную клетку. В такой системе реализуются все возможные пути переноса, но подобные штаммы и плазмиды обладают такими генетическими свойствами, чтобы можно было отобрать реципиентную клетку, получившую данный плазмидный вектор. Предположим, что мы имеем три штамма: 1) штамм А, который несет конъюгативную мобилизуемую плазмиду, но не может расти на минимальной питательной среде и чувствителен к антибиотику X; 2) штамм В, который также не может расти на минимальной питательной среде и несет неконъюгативный плазмидный вектор, который имеет ген резистентное™ к антибиотику X; 3) штамм С — рецепиентная клетка-мишень, которая может расти на минимальной среде, не имеет несовместимых плазмид и чувствительна к антибиотику X. После конъюгации клетки непродолжительное время выращивают на полноценной среде без антибиотика X, а затем переносят их на минимальную среду с антибиотиком. В этих условиях могут расти только реципиентные клетки-мишени, которые приобрели плазмидный вектор. Иногда клетка-мишень получает обе плазмиды, однако этот редкий случай можно выявить, если перенести клетки путем перепечатки на минимальную среду и отобрать трансконъюганты, которые способны расти в присутствии антибиотика X, но не могут расти при наличии гена резистентности к другому антибиотику (например, к антибиотику Y), который имеется в конъюгативной плазмиде штамма А. Поскольку для переноса плазмидной ДНК должна произойти конъюгация между тремя бактериальными штаммами, эта процедура получила название тройного скрещивания.
78ГЛАВА 4
ЗАКЛЮЧЕНИЕ
Технология рекомбинантных ДНК включает целый набор экспериментальных процедур, благодаря которым удается выделить (клонировать) фрагменты ДНК, содержащие специфические гены. Успех клонирования зависит от возможности воспроизводимо разрезать молекулу ДНК на фрагменты определенного размера. Для точного расщепления ДНК используют рестрици-рующие эндонуклеазы типа 11. Эти ферменты узнают специфические нуклеотидные последовательности и симметрично разрезают фосфодиэфирные связи в каждой цепи.
Типичный эксперимент по клонированию генов включает следующие этапы. 1. Рестриктазное расщепление ДНК, выделенной из организма, который содержит искомый ген. 2. Обработка вектора для клонирования (обычно плазмидного). который может реплицироваться в клетке-хозяине, теми же рестриктазами, которые использовались для расщепления донорной ДНК. 3. Смешивание этих двух образцов ДНК и сшивание фрагментов ДНК-лигазой фага Т4. 4. Трансформация сшитыми молекулами клеток-хозяев. Амплификация рекомбинантной ДНК в трансформированных клетках.
Для отбора клеток, содержащих рекомбинантную ДНК, используют специальные приемы. Чтобы уменьшить количество кольцевых плазмидных молекул, образующихся при сшивании фрагментов ДНК-лигазой Т4, рестрици-рованную плазмидную ДНК обрабатывают щелочной фосфатазой, удаляющей 5'-концевые фосфатные группы. Для отбора трансформированных клеток, содержащих гибридные плазмиды, проводят: 1) тестирование на резистент-ность к определенным антибиотикам или колориметрическую реакцию; 2) иммунологические тесты или выявление специфического белка — продукта клонированного гена; 3) гибридизацию с зондом, комплементарным какому-либо участку искомого гена.
Чтобы иметь возможность клонировать целый ген, донорную ДНК расщепляют лишь частично. При этом получаются фрагменты разной длины, из которых затем создают геномную библиотеку. Для клонирования крупных фрагментов ДНК были сконструированы векторы на основе бактериофагов λ и Р1, а также плазмиды F.
Для получения фрагментов ДНК, кодирующих эукариотические белки, на очищенной мРНК как на матрице синтезируют комплементарную цепь ДНК с помощью обратной транскриптазы; эта цепь в свою очередь используется в качестве матрицы для синтеза второй цепи. После ферментативной обработки эту двухцепочечную комплементарную ДНК встраивают в вектор.
Независимо от того. Какая именно стратегия клонирования используется, после идентификации клонированной последовательности необходимо показать, что она представляет собой нативный структурный ген.
ЛИТЕРАТУРА
Berger S. L, A. R. Kimmel(ed.). 1987. Methods in Enzymotogy, vol. 152. Guide to Molecular Cloning Techniques. Academic Press, London, United Kingdom.
Garfin D. E. 1995. Electrophoretic methods, p. 53-109. In ]. A. Glasel and M. P. Deutscher (ed.), Introduction to Biophysical Methods for Protein and Nucleic Acid Research. Academic Press, San Diego, Calif.
Grinstead J.t P. M. Bennett(ed.)· 1988. Methods in Microbiology, vol. 21, Plasmid Technology. Academic Press, London, United Kingdom.
loannou A. P., C. T.Amemiya, J. Games, P. M. Kroisel, H. Shizuya, C. Chen, M. A. Batzer, P. J. de Jong.1994. Anew bacteriophage-derived vector for tlie propagation of large human DNA fragments. Nat. Genet. 6: 84-89.
Kim U.-J., B. W. Birren, T.Slepak, V. Mancino, C.Boysen, H.-L. Kang, M. I. Simon, H. Shizuya.1996. Construction and characterization of a human bacterial artificial chromosome library. Genomics34: 213—218.
Leonardo E. D., J. M. Sedivy.1990. A new vector for cloning large eukaryotic DNA segments in Escherichia coli. Bio/Technology 8: 841 —844.
Martin C., L. Bresnick, R.-R. Juo, J. C.Voyta, L Bronstein.1991. Improved chemiluminescent DNA sequencing, BtoTechniques 11:110-114.
Old R. W., S. B. Primrose,1985. Principles of Gene Manipulation, 3rd ed. Blackwell Scientific Publications, Oxford, United Kingdom.
Sambrook JM E. F. Fritsch, T. Maniatis.1989. Molecular Cloning: a Laboratory Manual, 2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.
Технология рекомбинантных ДНК 79
Slightom J. L., R. F. Drong, P. P. Chee.1993. Construction of λ clone banks, p. 121—146. In B. R. Click and J. E. Thompson (éd.), Methods in Plant Molecular Biology and Biotechnology. CRC Press, Boca Raton, Fla.
Southern E.1975. Detection of specific sequences among DNA fragments separated by gel elec-trophoresis. J. Mol. Biol. 98: 503-507.
Winnacker E.-L.1987. From Genes to Clones: Introduction to Gene Technology. VCH, New York, N.Y.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое эндонуклеазы рестрикции типа II и почему они так важны для технологии рекомбинантных ДНК?
2. При обработке кольцевой двухцепочечной плазмиды pCELl различными рестриктазами и их комбинациями получаются следующие фрагменты (размеры указаны в парах нуклео-тидов): EcoRI - 6,0; ВатIII - 6,0; HindIII -6,0; НаеII - 3,0; 2,0 и 1,0; EcoRI и НаеII - 2,0 и 1,0; EcoRI и HindIII - 3,5 и 2,5; EcoRI и ВатHI - 4,5 и 1,5; ВатHI и HindIII - 5,0 и
1,0; ВатШ и Haell - 3,0; 1,5 и 0,5; HindIII и НаеII — 3,0; 1,5; 1,0 и 0,5. Используя эти данные, постройте рестрикционную карту pCELl.
3. Опишите применение плазмиды pBR322 в качестве вектора. Какими особенностями она обладает?
4. Опишите основные свойства системы клонирования pUC.
5. Обычно банк клонов создают лигированием плазмидного вектора, подвергнутого исчерпывающему гидролизу с помощью BamHI, с хромосомной ДНК, частично гидролизован-ной рестриктазой Sau3АI.
а. Почему в этом эксперименте используется два разных фермента?
б. Что такое частичный гидролиз и как его проводят?
в. Почему к нему часто прибегают для создания банков клонов?
6. Зачем рестрицированную плазмидную ДНК перед лигированием часто обрабатывают щелочной фосфатазой?
7. Опишите способы введения рекомбинантных плазмид в грамотрицательную бактерию, например в E. coli.
ГЛАВА 5
Химический синтез, определение нуклеотидной последовательности и
амплификация ДНК
Технологический прогресс в любой области науки всегда стимулирует ее дальнейшее развитие. С появлением новых технологий появляется возможность ставить новые эксперименты и облегчается проведение старых. Становление молекулярной биотехнологии как науки обязано целому ряду технологических разработок; многие из них ныне широко применяются как в крупных исследовательских центрах, так и небольших научных коллективах. Теперь не составляет особого труда химически синтезировать одну молекулу ДНК, определить нуклеотидную последовательность другой и амп-лифицировать с помощью полимеразной цепной реакции третью. Все это стало возможным благодаря той информации, которая была получена в ходе основополагающих исследований как самой ДНК, так и механизма ее репликации. Эти экспериментальные подходы стали неотъемлемой частью молекулярного клонирования -- процедуры, позволяющей выделять из ДНК нужные фрагменты, охарактеризовывать их и производить с ними разнообразные манипуляции.
Химический синтез ДНК
С разработкой быстрых и недорогих методов химического синтеза одноиепочечных ДНК-фрагментов с заданной нуклеотидной последовательностью методология молекулярного клонирования и характеризации ДНК существенно изменилась. Химически синтезированные олигонуклеотиды можно использовать для конструирования целых генов или их фрагментов, для амплификации специфических фрагментов ДНК, для направленных мутаций изолированных ДНК, а также в качестве зондов при гибридизации и в качестве линкеров, облегчающих клонирование.
С появлением приборов для автоматического химического синтеза ДНК (ДНК-синтезаторов) получение одноцепочечных олигонуклеотидов длиной <50 звеньев стало более или менее рутинной процедурой. Основным компонентом любого ДНК-синтезатора является система клапанов и насосов, с помощью которых в реакционную смесь по строго заданной программе вводятся нуклеотиды и реагенты, обеспечивающие присоединение нужных мономерных единиц к растущей цепи. В отличие от биологического, в ходе химического синтеза ДНК каждый новый нуклеотид можно присоединять к 5'-гидроксильному концу цепи. Все реакции осуществляются последовательно в одной реакционной колонке, а продолжительность каждой из них и время отмывания контролируются с помощью компьютера.
Фосфорамидитный метод
В настоящее время это наиболее распространенный метод химического синтеза ДНК. Исходными строительными блоками в нем являются модифицированные дезоксирибонуклеозиды. Модификация состоит в присоединении к аминогруппам дезоксиаденозина и дезоксицитидина бензольной группы, а к аминогруппе дезоксигуанозина — изобутирильной. Тимидин, у которого отсутствует аминогруппа, не модифицируют. Такая модификация необходима для защиты нуклеозидов от нежелательных побочных реакций при росте цепи. Синтез осуществляют в
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК 81
твердой фазе (растущая цепь ДНК фиксируется на твердом носителе), что позволяет проводить все реакции в одной емкости, легко отмывать после каждого этапа ненужные реагенты и добавлять новые в количестве, обеспечивающем возможно полное протекание реакции.
Этапы многоступенчатого синтеза представлены на рис. 5.1. Первый нуклеозид (азотистое основание + сахар) фиксируют на инертном твердом носителе, обычно это пористые стеклянные шарики с порами одинакового размера. 3'-гидроксильная группа первого нуклеозида, который будет 3'-концевым нуклеотидом синтезируемой цепи, прикрепляется к спейсерной молекуле, ковалентно связанной с носителем. Чтобы предотвратить неспецифическое взаимодействие 5'-гидроксильной группы первого нуклеотида до добавления в реакционную смесь второго нуклеотида, ее защищают с помощью диметокситритильной (ДМТ) группы (рис. 5.2). Такую группу содержит каждый присоединяемый к растущей цепи нуклеотид, а кроме того, он несет диизопропиламинную группу, присоединенную к 3'-фосфитной группе, которая в
| Рис. 5.1. Химический синтез олигонуклеотида. После n циклов образуется одноцепочечный фрагмент ДНК из n + 1 нуклеотида. | 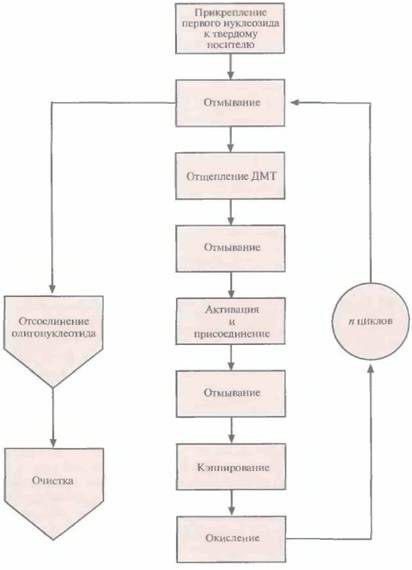
|
82 ГЛАВА 5
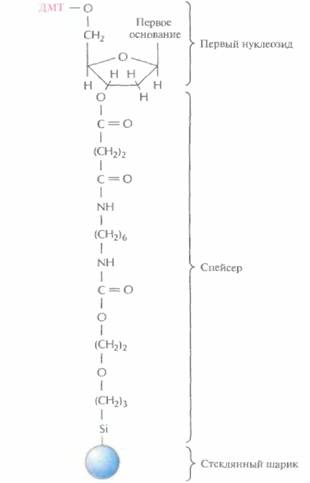
| Рис. 5.2. Комплекс, с которого начинается химический синтез цепи ДНК. К 5'-гидроксильной группе дезоксирибозы первого нуклеозида присоединена ди-метокситритильная (ДМТ) группа, а к 3'-гидроксиль- ной группе — спейсерная молекула. Последняя в свою очередь связана с твердым носителем (пористым стеклянным шариком). |
|
из
5.00
|
Обсуждение в статье: Tobias J. W., T. E. Schrader, G. Rocap, 7 страница |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

