 |
Главная |
Tobias J. W., T. E. Schrader, G. Rocap, 10 страница
|
из
5.00
|
Регулируемые промоторы
Наиболее широко используются следующие сильные регулируемые промоторы: промоторы lac- и trp-оперонов E. соli; специально сконструированный tac-промотор, включающий — 10-область lас-промотора и — 35-область trp-промотора (участки, находящиеся на расстоянии 10 и 35 п. н. до сайта инициации транскрипции); левый, или pL, промотор бактериофага λ; промотор гена 10 бактериофага Т7. С каждым из них связываются соответствующие репрессоры, которые опосредуют включение и выключение транскрипции специфических генов. Кроме того, каждый из этих промоторов узнается холо-ферментом РНК-полимеразой E. coli, в который входит основной сигма-фактор, присутствующий в клетке в значительно больших количествах, чем другие, минорные сигма-факторы. Благодаря этому транскрипция не останавливается по причине недостатка свободных сигмафакторов.
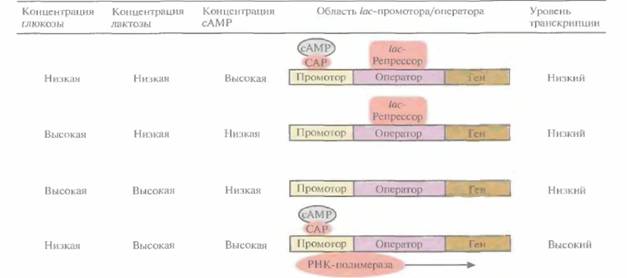
В отсутствие лактозы в среде lас-промотор E. coli находится в репрессированном состоянии, т. е. он выключен белком-репрессором, блокирующим транскрипцию lac-оперона. Индукция, или включение lac-оперона происходит при добавлении в среду лактозы или изопропил-β-D-тиогалактопиранозида (ИПТГ). Оба этих соединения предотвращают связывание репрессора с lac-оператором, и транскрипция возобновляется.
Транскрипция, контролируемая lac-промотором, регулируется также с помощью белка -активатора катаболизма (САР) (рис. 6.2). При связывании САР с промотором повышается сродство последнего к РНК-полимеразе и усиливается транскрипция примыкающих к нему генов. В свою очередь сродство САР к промотору повышается при его связывании с цикличе-
|
| Рис. 6,2. Влияние глюкозы, лактозы и сАМР на транскрипцию, регулируемую lac-промотором E. coli. Стрелка указывает направление транскрипции. (По данным работы Abeles et al., 1992, Biochemistry, p. 383, Jones and Bariett Publishers, Boston, Mass.) |
108 ГЛАВА 6
ским AMP (сАМР), уровень которого повышается при снижении концентрации глюкозы в среде. Таким образом, если репрессор не связан с оператором, то в присутствии индуктора при повышении внутриклеточной концентрации сАМP может произойти усиление транскрипции генов, регулируемых laс-промотором.
На самом деле в плазмидных экспрессируюших векторах используется один из вариантов lac-промотора — lacUV5 сизмененной -10-последовательностью, более сильный, чем laс-промотор дикого типа. Транскрипция с промотора tac также подавляется lac-репрессором и возобновляется при добавлении в среду лактозы или ИПТГ.
Промотор trp выключается под действием комплекса триптофан—trp-репрессор, который связывается с trp-оператором и предотвращает транскрипцию trp-оперона. Активация (включение) trp-промотора происходит либо при удалении из среды триптофана, либо при добавлении 3-индолилакриловой кислоты.
Работа промотора рL- регулируется репрессорным белком cl бактериофага λ. На самом деле для регуляции транскрипиии с pL-промотора обычно используется термочувствительная му-тантная форма репрессора cI — белок сI857. Клетки, синтезирующие этот репрессор, сначала выращивают при температуре 28—30 °С; в этих условиях репрессор блокирует транскрипцию с pL-промотора. Когда культура достигает нужной фазы (как правило, середины log-фазы), температуру повышают до 42 °С, при которой сI857-репрессор инактивируется и начинается транскрипция.
Для транскрипции с промотора бактериофага Т7 нужна соответствующая РНК-полимераза. Чтобы можно было использовать этот промотор, ген РНК-полимеразы фага Т7 встраивают в хромосому E. coli в составе профага λ, поместив его подконтроль lac-промотора. Затем клетки трансформируют плазмидой, содержащей генмишень под контролем Т7-промотора, и добавляют в среду ИПТГ. В этих условиях происходит индукция гена РНК-полимеразы Т7, синтезируется РНК-полимераза и происходят транскрипция и трансляция клонированного гена. Часто между временем индукции гена РНК-полимеразы Т7 и началом транскрипции гена-мишени проходит более часа. Для транскрипции с сильного Т7-промотора создана целая серия плазмид, получивших название рЕТ-векторов.
Эффективность инактивации белка-репрессора и соответственно активации транскрипции зависит от соотношения между числом молекул репрессора и числом копий промотора. Если концентрация репрессора слишком велика, то транскрипция не инициируется, и наоборот, если молекул репрессора очень мало (даже при том, что их больше, чем копий промотора), то транскрипция может идти и в отсутствие индукции. Про такие промоторы говорят, что они «текут». Чтобы осуществлять строгий контроль таких регулируемых систем, разработаны разные стратегии. Например, ген репрессора и соответствующий промотор помещают в две разные плазмиды, присутствующие в клетке в разном числе копий; это позволяет поддерживать нужное соотношение между числом молекул репрессора и числом копий промотора. Обычно ген репрессора находится в малокопийной плаз-миде, число ее копий в клетке не превышает 8, а промотор -- в мультикопийной плазмиде с 30—100 копиями на клетку. Ген репрессора может быть локализован и в хромосомной ДНК, находясь в ней в единственном числе, что позволяет поддерживать низкую концентрацию репрессора. В системах, использующих laс-промо-тор, можно получить lac-репрессор в значительно большем количестве, если заменить lacI-ген его мутантной формой laсIq, что приводит к уменьшению «протекания» промотора, т. е. к снижению уровня транскрипции клонированного гена без индуктора.
Получение больших количеств белковых продуктов
Для получения больших количеств чужеродных белков с помощью рекомбинантных штаммов E. coli была сконструирована плазмида pPLc2833. Она содержит сильный промотор, селективный маркерный ген и короткий участок с несколькими уникальными сайтами для рестрицирующих ферментов (полилинкер), следующий непосредственно за промотором. Эффективность этого экспрессируюшего вектора в осуществлении синтеза чужеродных белков в Е. соli можно еще
Оптимизация экспрессии генов, клонированных в прокариотических системах 109
| Таблица 6. I. Зависимость числа копий трех плазмидных экспрессирующих векторов от температуры1) | |

| |
больше повысить, заменив сайт инициации репликации плазмиды pPLc2833 аналогичным сайтом плазмиды рКМ402. Это приводит к увеличению числа копий модифицированной плазмиды в 5-10 раз при температуре 42 °С (табл. 6.1), Полученная таким образом плазмида рСРЗ содержит pL-промотор и ген ß-лактамазы (ген устойчивости к ампициллину) из pPLc2833, a сайт инициации репликации - из pKN402 (рис. 6.3). Несущие ее клетки сначала выращивают при температуре 28 °С, а затем — при 42 °С. При пониженной температуре ген cI-penpeccopa, интегрированный в ДНК E. соli, экспрессируется, pL-npoмотор не функционирует и образуется обычное число копий плазмиды (табл. 6.1). При повышении температуры cl-penpecop инактивируется, pL-промотор переходит в активное состояние, и число копий плазмиды увеличивается. Все это и делает плазмиду рСР3 эффективным экспрессирующим вектором. Когда ген ДНК-лигазы Т4 был встроен в полилинкер рСР3, то выход его продукта составил примерно 20% от общего количества белка, синтезируемого Е. соli при 42 °С. При этом на долю собственных, наиболее активно синтезируемых белков E, coli, например фактора элонгации EF-Тu,приходится примерно 2%.
Крупномасштабные системы
При культивировании в небольших объемах (от l до 5 л) индукцию экспрессии осуществляют либо изменением температуры, либо добавлени-
| Рис. 6.3. Создание плазмиды рСР3. Из плазмиды pKN402 с помощью рестрицирующей эндонуклеазы HaeIIвырезают фрагмент с, содержащий температурочувствительный сайт инициации репликации (ori), и сшивают его с НаeII-фрагментами 1 и 3 плазмиды pPLc2833. Фрагмент 1 содержит pL--промотор и полилинкер (ПЛ), а фрагмент 3 - селективный маркерный ген устойчивости к ампициллину (Ampr). | 
|
110 ГЛАВА6
ем химического индуктора. Однако в опытных установках (20—100 л) и в промышленных биореакторах (>200 л) температуру нельзя изменить мгновенно, для этого требуется время от 30 до 60 мин; кроме того, на подъем температуры нужна энергия. И время, и энергия стоят дорого. Столь же дорого обходится и применение химического индуктора, например ИПТГ. Все это может сделать процесс неэкономичным. Для преодоления некоторых проблем, связанных с использованием pL-промотора для крупномасштабного производства белковых продуктов, была разработана двухплазмидная система. Ген репрессора cI поместили под контроль trр-про-мотора и включили в малокопийную плазмиду (рис. 6.4), что обеспечило невысокий уровень синтеза репрессора. Вторая плазмида содержала клонированный ген, находящийся под контролем pL-промотора. Как видно из рис. 6.4, А, в отсутствие триптофана включается trр-промотор и синтезируется репрессор cI, выключающий pL-промотор. И наоборот, как видно из рис. 6.4, Б, при наличии триптофана trp-промотор выключается, репрессор не синтезируется, а pL-промотор активно работает.
Культуры с такими двухплазмидными системами можно выращивать на недорогих средах на основе гидролизатов мелассы или казеина, содержащих незначительное количество свободного триптофана, и индуцировать экспрессию клонированного гена добавлением в среду трип-тона. Последний содержит свободный триптофан в количестве, достаточном для эффективной индукции транскрипции. Пробные испытания этой системы показали, что на долю продуктов клонированных генов ß-лактамазы и цитратсин-

| Рис. 6.4. Двухплазмидная система, позволяющая контролировать работу pL-промотора фага λ путем регуляции синтеза cl-peпрессора с помощью триптофана. Ген репрессора cI вместе с триптофановым промотором (р trp) находятся в одной плазмиде, а pL-промотор и клонированный ген — в другой. Стрелками указано направление транскрипции. А. В отсутствие триптофана в среде ген cI транскрибируется и транслируется, репрессор cI связывается с pL-промотором и блокирует транскрипцию клонированного гена. Б. В присутствии триптофана ген cI репрессируется, его продукт не синтезируется, поэтому клонированный ген транскрибируется и транслируется. |
Оптимизация экспрессии генов, клонированных в прокариотических системах 111
тазы после индукции транскрипции добавлением триптона приходится соответственно 21 и 24% от общего количества синтезируемого белка. Таким образом, двухплазмидные системы позволяют получать белковые продукты с помощью реком-бинантных микроорганизмов в промышленных масштабах и относительно недорого.
Использование для экспрессии других микроорганизмов
Е. coll — не единственный микроорганизм, который используется для синтеза чужеродных белков. К сожалению, генетические и молекулярно-биологические свойства большинства других микроорганизмов изучены не так хорошо. Кроме того, нет ни одного вектора или даже промо-торно-репрессор ной системы, которая обеспечивала бы оптимальный уровень экспрессии в клетках всех или хотя бы только грамотрицательных бактерий. К счастью, многие стратегии, разработанные для Е. coli, пригодны и для множества других микроорганизмов, что позволило проверить различные промоторы на их способность обеспечивать транскрипцию в других гра-мотрицательных бактериях. Так, в одном из исследований был сконструирован набор плазмидных экспрессирующих векторов, содержащих промоторы lас, tac, Nm (гена устойчивости к неомицину) и SI (гена рибосомного белка S1 Rhisobium meliloti), и определен уровень экспрессии гена ß-лактамазы под контролем каждого из них (табл. 6.2). Обнаружилось, что: 1) указанные промоторы проявляют ту или иную активность во всех использованных бактериальных системах; 2) промотор tac наиболее активен в Е. coli и гораздо менее — в других бактериях; 3) Nm — второй по активности промотор в E. coli и самый активный в других бактериях. Промоторные участки у всех грамотрицательных бактерий имеют сходную нуклеотидную последовательность, однако это не означает, что самым эффективным промотором для того или иного организма будет тот, который наиболее эффективен в Е. coli. Тем не менее Е. соli-промоторы могут оказаться вполне приемлемыми для регуляции экспрессии клонированных генов и в других грамотрицательных бактериях.
Попытки создания «универсального» экспрессирующего вектора для грамотрицательных бактерий были весьма многочисленными. В конце концов была выбрана следующая стратегия. Фрагмент ДНК размером 70 п. н., происходящий от одного из концевых инвертированных повторов в транспозоне 5 (Tn5), встроили вместе с соответствующим промотором в полилинкер малокопийной плазмиды pRK290 с широким спектром хозяев и получили плазмиду pAV10 (рис. 6.5). Клонированный сегмент ДНК из Tn5 содержал два независимых, но перекрывающихся промотора, каждый из которых необходим для транскрипции одного из ключевых Tn5-генов. Поскольку Tn5 эффективно экспрессируется в разных бактериях, его промоторы можно использовать для транскрипции различных генов. Чтобы проверить это, в полилинкер сразу за клонированными промоторами Тn5 встроили гены хлорамфеникол-ацетил-трансферазы и ß-галактозидазы. Их эффективная экспрессия происходила в клетках Alcaligenes sp,, E. coli, Enterobacter cloacae, Klebsiella pneumoniae, Pseudomonas stuizeti, Pseudomonas fluorescens и Serratia marcescens. Таким образом, есть реаль-
| Таблица 6.2.Активность ß-галактозидазы в грамотрицательных бактериях, несущих плазмидный вектор с геном lacZ E.coli игетерологичным промотором1) | ||||
| Промотор | Активность ß-галактозидазы, ЕД | |||
| Escherichia coli | Rhizobium meliloti | Rhizobium leguminosarum | Pseudomonas putida | |
| Отсутствует | ||||
| Nm | ||||
| lac | ||||
| tac | ||||
| S1 | ||||
| 1) По данным Labes et al., 1990, Gene 89: 37—46. |
112 ГЛАВА 6

|
| Рис. 6.5. Клонируюший вектор pAV10 (без соблюдения масштаба). Показано положение гена устойчивости к тетрациклину (Tetr), сайта рестрикции для эндонуклеазы BglII, сайта инициации репликации (on), промотора (p) и полилинкера (ПЛ). Встраивание клонированного гена в полилинкер ставит его под контроль промотора Тn5 (р). Стрелка указывает направление транскрипции. |
ная возможность использовать Тn5-промоторы для инициации транскрипции чужеродных генов в клетках различных бактерий.
Химерные белки
Очень часто чужеродные белки, особенно небольшие, обнаруживаются в гетерологичных хозяйских клетках лишь в минимальных количествах. Такой кажущийся низкий уровень экспрессии кодирующих их генов во многих случаях объясняется деградацией чужеродных белков в хозяйских клетках. Один из способов решения этой проблемы состоит в ковалентном присоединении продукта клонированного гена к какому-нибудь стабильному белку клетки-хозяина. В составе подобной конструкции, получившей название «химерный белок», продукт клонированного гена оказывается защищенным от расщепления протеазами хозяйской клетки, что было показано в ходе экспериментов.
Слияние белков программируется на уровне ДНК лигированием кодирующих участков соответствующих генов. В самом простом виде векторная система слияния предусматривает включение гена-мишени или его сегмента в кодирующий участок клонированного гена-хозяина. Очень важно, чтобы РНК. транскрибируемая с клонированного гена-мишени, имела правильную нуклеотидную последовательность, обеспечивающую образование продукта клонированного гена. Если при объединении сегментов ДНК происходит изменение рамки считывания, т. е. последовательность колонов детерминирует укороченный или неправильный трансляционный продукт, то не сможет образоваться и функционально активная форма белка. Убедиться в правильности рамки считывания можно разными способами. Как правило, для этого необходимо знать точную нуклеотидную последовательность лигируемых фрагментов ДНК,
Расщепление химерных белков
В зависимости от предназначения белкового продукта клонированного гена он может использоваться как таковой или в составе химерного белка, причем последний вариант встречается нечасто. Например, из-за присутствия фрагмента хозяйского белка большинство химерных белков оказываются непригодными для применения в клинике, а сам продукт клонированного гена-мишени может оказаться неактивным. Кроме того, для химерных белков предусмотрена более сложная процедура тестирования, которую они должны пройти, чтобы получить разрешение к применению у соответствующих организаций. Все это заставляет искать способы удаления лишних аминокислотных последовательностей из молекулы получаемого продукта. Один из таких способов основан на присоединении белка, кодируемого геном-мишенью, к белку клетки-хозяина, содержащему короткий пептид, распознаваемый специфической протеазой небактериального происхождения. Такое присоединение тоже программируется на уровне ДНК. Олигонуклеотидные линкеры, несущие сайты для протеаз. можно пришить к клонированному гену до того, как такая конструкция будет введена в экспрессирующую векторную систему слияния. Линкером может служить, например, олигонуклеотид, кодирующий пептид Ile-Glu-Gly-Arg. После синтеза и очистки химерного белка для отделения белкового продукта, кодируемого клонированным геном, можно использовать фактор свертывания крови Ха, который является специфической протеиназой, разрывающей пептидные связи исключительно на С-конце последовательности Ile-Glu-Gly-Arg (рис. 6,6). Более того, поскольку такой пептид
Оптимизацияэкспрессии генов, клонированных в прокариогических системах 113

|
| Рис. 6.6. Протеолитическое расщепление химерного белка фактором свертывания крови Ха. Фактор Ха узнает аминокислотную последовательность, разделяющую два компонента химерного белка. После расщепления высвобождается функциональный белок, кодируемый клонированным геном. |
встречается в природных белках довольно редко, этот подход можно использовать для отделения многих других продуктов, кодируемых клонированными генами.
Применение химерных белков
В некоторых случаях конечным продуктом, который предполагается использовать, является сам химерный белок. Например, нередко возникает необходимость в получении антител, узнающих конкретный участок белковой молекулы. Чтобы решить эту задачу, можно встроить в подходящий вектор сегмент ДНК, кодирующий белковый домен, к которому будут вырабатываться нужные антитела. Образующийся в результате химерный белок и будет служить антигеном. Антитела к стабилизирующему его белковому компоненту, происходящему от хозяйской клетки, можно удалить абсорбцией их на чистом стабилизирующем белке, и тогда останутся только антитела, связывающиеся с нужной аминокислотной последовательностью.
Один из клонирующих векторов системы слияния, сконструированных для получения специфических антител, содержит 5'-концевой сегмент гена ompF E. coli, кодирующего один из наружных мембранных белков, и прилегающую к нему часть гена lacZ (ß-галактозидазы) E. coli (рис. 6.7). Этот сегмент содержит информацию, необходимую для инициации транскрипции и трансляции химерного гена, а также для секреции химерного белка. Несмотря на то что укороченный ген lacZ, лишен кодонов для первых восьми аминокислот, кодируемый им белок сохраняет ферментативную активность. В такой форме ß-галактозидаза способна функционировать независимо от того, какие пептиды присоединены к ее N-концу. Ген lacZ встроен в вектор таким образом, что он попадает «не в ногу» с рамкой считывания лидерной последовательности ompF, поэтому активная ß-галактозидаза не образуется. Однако если рамка считывания какого-либо клонированного фрагмента ДНК согласуется с таковой для генов ompF и LacZ, то образуется трех компонентны и химерный белок, состоящий из OmpF-фрагмента, белка, кодиру-

| Рис. 6.7. Клонирующий вектор системы слияния. Он содержит ген устойчивости к ампициллину (Атрг) в качестве селективного маркера, 5 '-концевой сегмент гена ompF, колирующий N-конец наружного мембранного белка, сайт для рестрицирующей эндонуклеазы AbcIи укороченный ген ß-галактозидазы (lacZ). Ген, который хотят клонировать, встраивают в АbcI-сайт. После транскрипции и трансляции этой генетической конструкции образуется трехкомпонентный химерный белок. |
114 ГЛАВА 6
| Таблица 6.3. Очистка химерных белков, продуцируемых Е. соli1' | |||
| Компонент химерного белка, связывающийся с антителом2' | Размер | Антитело | Условия элюирования |
| ZZ | 14 кДа | IgG | Низкий pH |
| Гистидиновый «хвост» | 6-10 аминокислот | Ni2+ | Имидазол |
| Strep-tag | 10 аминокислот | Стрептавидин | Иминобиотин |
| PinPoint | 13кДа | Сгрептавидин | Биотин |
| МБР | 40кДа | Амилоза | Мальтоза |
| ß-Лактамаза | 27кДа | Фенилборат | Борат |
| GST | 25кДа | Глутатион | Восстанавливающий реагент |
| Flag | S аминокислот | Специфическое моноклональное антитело | Низкая концентрация кальция |
| 1) По данным работы Nygren et al., 1994, Tnnds Biolecfutol, 12: 184-188, | |||
| 2) ZZ - фрагмент белка A Staptyjaaxcus aufeus, Strep-lag - пептид, обладающий сродством к стрептавидину; PinPoint - белковый фрагмент, биотинилированный в Е, coli In vivo; MBP — мальтозосвязываюший белок; GST — глутатион S-трансфераза; Flag — пептид, узнаваемый энтерокиназой. |
емого клонированным геном, и функционально активной С-концевой части ß-галактозидазы. Он может использоваться как антиген для выработки антител, дающих перекрестную реакцию с белком клонированного гена, или как инструмент для получения небольших фрагментов специфических белков.
Химерные белки используются не только для стабилизации полипептидов, но и для упрощения процедуры очистки рекомбинантных белков (табл. 6.3). Так, плазмидная конструкция Saccharomyces cerevisiae, содержащая ген человеческого интерлейкина-2 с присоединенным к нему сегментом ДНК, кодирующим маркерный пептид Asp-Туг- Lys-Asp-Asp-Asp-Asp-Lys (он продается под названием Flag), выполняет двоякую функцию: обеспечивает стабилизацию продукта гена интерлейкина-2 и облегчает его очистку. Интерлейкин-2 — это биологический фактор, стимулирующий рост Т-клеток и синтез В-клеточных антител. Химерный белок, образующийся после экспрессии этой генетической конструкции в дрожжевых клетках, может быть очищен за один прием с помощью иммуноаффинной хроматографии. Для этого моноклональные антитела к маркерному пептиду фиксируют на полипропиленовом носителе и пропускают через колонку химерный белок, который связывается с этими антителами (рис. 6.8). Маркерный пептид — небольшая молекула, на его образование расходуется лишь малая часть клеточных ресурсов. Химерный белок обладает такой же биологической активностью, что и нативный интерлейкин-2. Однако если он предназначен для применения в клинике, то маркерный пептид необходимо удалить. Таковы требования государственных служб, контролирующих использование фармацевтических препаратов. Для этого можно использовать бычью энтерокиназу.
Многие белки, продуцируемые Е. соli, накапливаются в клетках в форме нерастворимых биологически неактивных телец включения. И хотя из таких структур часто удается получать в небольших количествах биологически активный белок, для этого приходится проводить продолжительную солюбилизацию. Плохая растворимость белков in vivo часто обусловливается их неправильной укладкой, и эту проблему пытались решить различными способами. Так, известно, что химерные белки, одним из компонентов которых является тиоредоксин, белок мол, массой 11,7 кДА, остаются в растворе, даже если на их долю приходится 40% суммарного клеточного белка. Имея это в виду, ген-мишень встроили в полилинкер сразу вслед за геном тиоредоксина, так чтобы оба этих гена попали под контроль pL-npoмотора в плазмидном векторе E. соli (рис. 6.9). В хромосоме хозяйских клеток E. соli, использующихся в этой системе, присутствует генетическая конструкция, детерминирующая образование репрессора cI — копия гена cI, находящаяся под транскрипционным контро-
Оптимизация экспрессии генов, клонированных в прокариотических системах 115
1. Смесь секретированных белков
 2. Подготовка колонки для иммуноаффинной хроматографии
2. Подготовка колонки для иммуноаффинной хроматографии
 3. Наслаивание смеси белков
3. Наслаивание смеси белков

|
4. Элюирование химерного белка
 Рис. 6.8. Очистка химерного белка с помощью иммуноаффинной хроматографии. Антитела к маркерному пептиду химерного белка фиксируют на твердом носителе и пропускают через колонку химерный белок. Маркерный пептид, входящий в состав химерного белка, связывается с антителами, а все остальные белки свободно проходят через колонку. Очищенный химерный белок элюируют из колонки.
Рис. 6.8. Очистка химерного белка с помощью иммуноаффинной хроматографии. Антитела к маркерному пептиду химерного белка фиксируют на твердом носителе и пропускают через колонку химерный белок. Маркерный пептид, входящий в состав химерного белка, связывается с антителами, а все остальные белки свободно проходят через колонку. Очищенный химерный белок элюируют из колонки.
|
лем промотора trp. В отсутствие триптофана (рис. 6.9, А) репрессор образуется в количестве, достаточном для блокирования транскрипции с pL-промотора, и химерный белок не синтезируется. Когда в среду добавляют триптофан (рис. 6.9, Б), trp- промотор выключается и белок-репрессор не синтезируется, а гены химерного белка транскрибируются с плазмидного pL-промотора. Синтезируемый химерный белок, состоящий из тио-редоксина и белка-мишени, концентрируется в основном в особых областях с внутренней стороны плазматической мембраны Е. соli, называемых зонами адгезии, и высвобождается из клеток при осмотическом шоке. Далее белок-мишень можно отщепить от химерного белка с помощью энтерокиназы. Химерный белок, содержащий тиоредоксин, можно очистить еще одним способом. Если белок-мишень остается стабильным лри повышении температуры, то, поскольку тиоредоксин не разрушается при нагревании вплоть до 80 °С, химерный белок можно инкубировать при высоких температурах и освободиться от большинства других клеточных белков, разрушающихся при этих условиях.
Включение белков в поверхностные структуры
Для скрининга обширных (до 5-1010 клонов) библиотек комплементарных ДНК (кДНК), кодирующих редко встречающиеся белки, были разработаны специальные системы слияния. Обьгчно кДНК встраивают в гены поверхностных белков (белков филаментов или пилей) нитчатых бактериофагов (например, М13) или бактерий и после транскрипции и трансляции получают химерные белки, входящие в состав поверхностных структур этих микроорганизмов. Здесь их идентифицируют иммунологическими методами. Часто для слияния используют ген поверхностного белка pIII фага М13, который связывается с F-пилями Е. coli и инициирует инфекцию. Для клонирования кДНК и других
|
из
5.00
|
Обсуждение в статье: Tobias J. W., T. E. Schrader, G. Rocap, 10 страница |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

