 |
Главная |
ВЗАИМОДЕЙСТВИЕ С ГАЛОИДНЫМИ СОЕДИНЕНИЯМИ ФОСФОРА И С ХЛОРИСТЫМ ТИОНИЛОМ
|
из
5.00
|
Галоидные соединения фосфора при действии спирта легко замещают их гидроксильную группу на галоген :
3R – OH + PCl3 → 3R – Cl + H3PO3;
R – OH + PCl5→ R – Cl + HCl + POCl3.
При взаимодействии PCl3 с первичными спиртами в качестве побочного прдукта образуется сложный эфир фосфористой кислоты :
3R – OH + PCl3 → (RO)3P + HCl
Для реакции со спиртами можно брать не готовые PBr3и PJ3, а вводить в реакционную смесь отдельно фосфор и галоген. В этом случае со спиртами реагируют галогениды фосфора в момент их образования:
2P + 3I2 = 2PI3; 3R – OH + PI3 → 3R – I + H3PO3
Хлорпроизводные с высоким выходом получают при действии на спирты хлористого тионила SOCl2 :
R – OH + SOCl2 → R – Cl + HCl↑ + SO2↑.
В этом случае образуются газообразные HCl и SO2, которые легко отделяются от галогеналкана.
Считают, что спирт сначала взаимодействует с SOCl2 и образует алкилхлорсульфит (1), который затем образует внутреннюю ионную пару (II), а она далее разлагается с сохранением конфигурации:

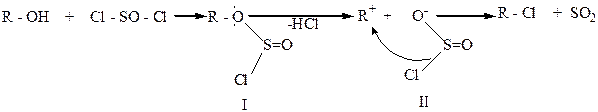
РЕАКЦИЯ ЭТЕРИФИКАЦИИ
Спирты вступают в реакцию с минеральными и органическими кислотами. Продуктами такого взаимодействия являются соответствующие сложные эфиры. Если в реакцию со спиртами вступает многоосновная кислота, то в зависимости от соотношения кислоты и спирта, введенных в реакцию, могут образовываться или кислые, или сложные эфиры:
|
|
|

ДЕГИДРАТАЦИЯ СПИРТОВ
Дегидратация спиртов может осуществляется в двух направлениях: внутримолекулярно и межмолекулярно. Направление дегидратации зависит от природы спирта и условий проведения реакции.
При внутримолекулярной дегидратации спирта образуется ненасыщенный этиленовый углеводород, в результате межмолекулярной дегидратации – простой эфир. Так, при нагревании спиртов с такими водоотнимающими веществами, как концентрированная H2SO4, H3PO4, безводная щавелевая кислота, оксид алюминия и т.д., образуются ненасыщенные соединения этиленового ряда.
Реакционная способность спиртов к дегидратации, то есть к образованию из них этиленовых соединений, изменяется в таком порядке:
третичные спирты > вторичные спирты >первичные спирты
Некоторые третичные спирты дегидратируются настолько легко, что их можно перегнать только в случае, если предотвратить попадание в них даже лабораторного воздуха, который содержит в незначительных количествах пары кислот.
Дегидратация спиртов в присутствии концентрированной H2SO4 в зависимости от температуры, соотношения объемов спирта и кислоты может осуществляться с образованием разных продуктов. Например, этиловый спирт при 105оС образует с серной кислотой кислый сложный эфир – этилсерную кислоту (реакция 1). При избытке спирта и более высокой температуре (130 –140оС) осуществляется межмолекулярная дегидратация, главным продуктом которой является диэтиловый эфир (простой эфир; реакция 2). При температуре выше 160оС этилсерная кислота разлагается с образованием этилена (реакция 3):

ПРАВИЛО ЗАЙЦЕВА
А.М.Зайцев (1875 г.) установил, что при отщеплении воды от спиртов образуются наиболее алкилированные этиленовые углеводороды (правило Зайцева). Например, при дегидратации 3-метилбутанола-2 отщепление воды осуществляется за счет гидроксила и атома водорода, который находится у соседнего наименее гидрогенизованного β-углеродного атома. В результате образуется 2-метилбутен-2:

Отщепление воды от спиртов по правилу Зайцева связано с образованием в ходе реакции промежуточных наиболее устойчивых карбкатионов, которые потом превращаются в наиболее алкилированные этиленовые углеводороды, термодинамически более устойчивые, чем менее алкилированные алкены.
Спирты легко дегидратируются и в газовой фазе над нагретым оксидом алюминия или пористой глиной. Например, из этилового спирта по этому методу получают этилен с высоким выходом:

АЛКИЛИРОВАНИЕ СПИРТОВ
Алкилированием называют реакции введения в молекулы органических веществ алкильных радикалов. При введении алкильного радикала в молекулу спирта вместо атома водорода ОН-группы получают простые эфиры. Алкилировать спирты можно спиртами, как это осуществляется при их межмолекулярной дегидратации:

Можно алкилировать спирты галоидными алкилами. Однако спирты являются слабыми нуклеофилами и с галоидными алкилами реагируют чрезвычайно медленно. Если реакцию галоидных алкилов проводить не со спиртами, а с алкоголятами, то простые эфиры образуются быстрее, поскольку алкоголят-ионы – сильные нуклеофилы и алкилирование в этом случае осуществляется очень активно:

метилэтиловый эфир
Алкилировать алкоголяты можно и диалкилсульфатами:

Взаимодействие алкоголятов с алкилгалогенидами является общим методом получения простых эфиров, известным под названием „синтеза Вильямсона”.
Реакция алкоголятов с галогеналкилами осуществляется по SN2 – механизму:

ОКИСЛЕНИЕ СПИРТОВ
Спирты при 300-400оС и в присутствии медных и других катализаторов окисляются кислородом воздуха. Такие окислители, как KMnO4, хромовая смесь, окисляют спирты уже при комнатной температуре. В зависимости от того, какой это спирт – первичный, вторичный или третичный – при окислении образуются разные продукты.
Первичные спирты при окислении дают альдегиды с таким же количеством углеродных атомов, как и в молекуле исходного спирта. Альдегиды в этих условиях могут окисляться в карбоновые кислоты. Чтобы избежать дальнейшего окисления, альдегиды необходимо быстро выводить из реакционной смеси:
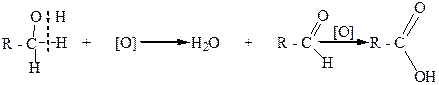
альдегид карбоновая кислота
Окисление спиртов хромовой смесью сопровождается изменением оранжево-красного окрашивания реакционной смеси (ионы Cr2O72-) на зеленое (ионы Cr3+):


Первичные спирты можно также окислить в альдегиды мелко раздробленной медью. Нагретой до 280-300оС. В этих условиях от молекулы спирта отщепляются два атома водорода и в молекуле органического вещества, которая при этом образуется, появляется двойная связь углерод – кислород (>C=O). Такое превращение спиртов называется дегидрированием:

Вторичные спирты при окислении, а также при дегидрировании, превращаются в кетоны:

Например, втор-пропиловый спирт в этих условиях превращается в кетон, который называют ацетоном:

Диметилкетон
(ацетон)
Третичные спирты окисляются достаточно трудно с одновременным разрывом углеродной цепи их молекул и образования смеси карбоновых кислот и кетонов. Такое окисление этих спиртов связано с тем, что в условиях реакции окисления они дегидратируются и превращаются в этиленовые углеводороды, которые в присутствии сильного окислителя окисляются с разрывом молекулы по месту двойной С=C - связи.
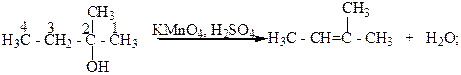
2- Метилбутанол-2 2-Метилбутен-2.
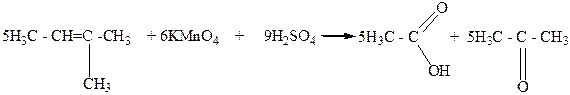
Уксусная Диемтилкетон
кислота (ацетон)
Таким образом, по продуктам окисления спиртов можно сделать вывод о строении спиртов.
ИДЕНТИФИКАЦИЯ СПИРТОВ
Спирты можно отличить от других классов органических веществ по цветной реакции с оксидом хрома (IV) в среде серной кислоты. Хромовый ангидрид CrO3 в водном растворе H2SO4 окисляет первичные и вторичные спирты, на протяжении приблизительно двух секунд прозрачный оранжевый раствор реакционной смеси становится голубовато-зеленым и мутнеет. Третичные спирты этой реакции не дают.
Для того, чтобы установить, каким является данный спирт – первичным, вторичным или третичным пользуются пробой Лукаса. Эта проба основана на разной реакционной способности спиртов относительно галогеноводородов. Спирты, молекулы которых содержат не больше шести углеродных атомов, растворяются в реактиве Лукаса, который представляет собой смесь концентрированной соляной кислоты и хлорида цинка. При растворении спирта в этом реактиве образуются соответствующие алкилхлориды, раствор мутнеет, поскольку алкилхлориды в реактиве Лукаса не ратсворяются. Время, необходимое для появления помутнения реактива Лукаса, является мерой реакционной способности спирта. Третичные спирты реагируют с реактивом Лукаса сразу же, вторичные спирты – на протяжении 5 минут, а первичные спирты прикомнатной температуре с этим реактивом почти не взаимодействуют.
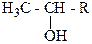 Этиловый спирт и спирты общей формулы взаимодействуют
Этиловый спирт и спирты общей формулы взаимодействуют
в щелочной среде с иодом и образуют иодоформ CHJ3 (иодоформная реакция). По способности давать иодоформную реакцию можно отличить данные спирты от других спиртов:

этиловый уксусный трииодуксусный иодоформ имеет
спирт альдегид альдегид неприятный запах
|
из
5.00
|
Обсуждение в статье: ВЗАИМОДЕЙСТВИЕ С ГАЛОИДНЫМИ СОЕДИНЕНИЯМИ ФОСФОРА И С ХЛОРИСТЫМ ТИОНИЛОМ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

