 |
Главная |
РЕАКЦИЯ С ГАЛОГЕНОВОДОРОДАМИ
|
из
5.00
|
Спирты легко реагируют с галогеноводородами и образуют при этом алкилгалогениды. Эта реакция является одной из наиболее важных при получении алкилгалогенидов. В реакцию вводят сухой газообразный галогеноводород, который пропускают через спирт или же спирт нагревают с концентрированным раствором кислоты. Реакционная способность спиртов вступать в реакцию замещения ОН-группы на галоген уменьшается в ряду:

 третичный > вторичный > первичный
третичный > вторичный > первичный
спирт спирт спирт
Галогеноводороды в реакции со спиртами также проявляют разную активность. Наиболее активным является иодоводород, наименее активным – хлороводород. Таким образом, по активности галогеноводороды можно расположить в следующий ряд:
HI > HBr > HCl
Так, наименее реакционноспособный галогенводород HCl реагирует с первичными спиртами только в присутствии ZnCl2, а наиболее реакционноспособные третичные спирты (например, третбутиловый спирт) легко реагирует с концентрированной соляной кислотой и при комнатной температуре быстро превращаются в третичные алкилхлориды:
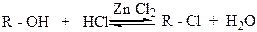

Реакция спиртов с галогеноводородами катализируется кислотами. Даже в том случае, когда водный раствор галогеноводорода является сильной кислотой, добавление к реакционной смеси серной кислоты ускоряет образование алкилгалогенида. Считают, что каталитическое действие кислот связано с образованием иона алкоксония ROH2+, который затем вступает в реакцию нуклеофильного замещения с ионом галогена. Причем третичные и вторичные спирты реагируют по SN1- механизму, а первичные спирты – по SN2 – механизму. Замещение гидроксильной группы третичного и вторичного спирта на галоген осуществляется в несколько стадий:

Сначала спирт присоединяет ион водорода и образует ион алкоксония (стадия 1), который далее дисссоциирует на воду и карбониевый ион (стадия 2 – наиболее медленная), карбониевый ион затем быстро присоединяет ион галогена и образует алкилгалогенид (стадия 3). Подтверждением такого SN1- механизма служит тот факт, что при замещении ОН-группы в третичных и вторичных спиртах на галоген наблюдается перегруппирование алкильных радикалов; галоген не всегда образует связь с тем атомом углерода, который сначала был соединен с гидроксильной группой. Например:


 Наличие такого рода перегруппировок свидетельствует об образовании в процессе реакции заряженных промежуточных частичек – карбониевых ионов.
Наличие такого рода перегруппировок свидетельствует об образовании в процессе реакции заряженных промежуточных частичек – карбониевых ионов.
Во время реакции замещения гидроксила на галоген в первичных спиртах алкильные радикалы перегруппировок не претерпевают. Поэтому считают, что первичные спирты реагируют по SN2 – механизму. То есть через стадию образования переходного состояния :

Хлороводород и бромоводород легко вступают в реакцию в момент образования, например, если на смесь солей NaCl или KBr со спиртом подействовать концентрированной H2SO4. При этом спирт сначала взаимодействует с серной кислотой и образует сложный эфир этой кислоты, который, например, в случае этилового спирта называется этилсерной кислотой:

|
Галогеноводородная соль образует с H2SO4 галогеноводород, который, взаимодействуя с эфиром серной кислоты. Дает галогеналкил:
NaCl + H2SO4 → HCl + NaHSO4;
 |
KBr + H2SO4→ HBr + KHSO4;
|
из
5.00
|
Обсуждение в статье: РЕАКЦИЯ С ГАЛОГЕНОВОДОРОДАМИ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

