 |
Главная |
Типы связей в кристаллах (конспективно)
|
из
5.00
|
Химическая связь в молекулах и кристаллах определяется строением и свойствами атомов.
Характеристики химической связи:
Ø энергия связи (Е, выделяемая при разрыве связи);
Ø кратность связи (количество электронных пар, связывающих два атома);
Ø длина связи (расстояние между ядрами атомов);
Ø элекроотрицательность - способность атома притягивать электроны;
Ø полярность связи (смещение электронной пары к одному из атомов = функция элекроотрицательности);
Ø направленность связи.
По типу химической связи различают ионную, ковалентную, металлическую, молекулярную (Ван-дер Вальсовскую).
1. Ионная связь ( рис. 1.1) :
Силы притяжения: кулоновская электростатическая сила (q2/R2).
Силы отталкивания – перекрытия электронных оболочек отталкивания ядер (а/Rм).
На примере NaCl: Единственный валентный электрон атома Na переходит на оболочку Cl => У Na и Cl образуются заполненные оболочки => разноименно заряженные ионы => притяжение. Ионы кристалла можно рассматривать как гигантскую ионную молекулу, в которой каждый из ионов взаимодействует со всеми остальными. Свойства ионной связи:
а) высокая энергия связи между ионами кристалле,
б) высокая прочность кристаллов,
в) высокая температура плавления,
г) низкая электропроводимость: изоляторы.
| |
| Рис. 1.1. Изменение потенциальной энергии пары атомов при их сближении и образовании молекулы. |
2. Металлическая связь.
Возникает в случае, когда число валентных электронов невелико. При этом они слабо связаны с ядрами. При образовании металлов электронные оболочки перекрываются и валентные электроны получают возможность перемещаться по кристаллу.
Свободные электроны связывают положительные ионы в прочную структуру.
а) Металлическая связь гибка и пластична => механические свойства
б) Высокая электропроводность металлов.
3. Связь Ван-дер-Вальса
Наблюдаются в молекулярных кристаллах.
Природа: кулоновское взаимодействие молекулярных диполей.
Типичный пример - вода, жидкие кристаллы.
а) Короткодействующие.
б) Ориентированные.
в) Слабые.
4. Ковалентная связь.
Большинство элементарных полупроводников и полупроводниковых соединений образуют кристаллические решетки с ковалентной связью.
Ковалентная связь образуется между одинаковыми или близкими по свойствам элементами в результате появления обменного эффекта.
Для наглядности рассмотрим образование ковалентной связи на примере молекулы водорода. При сближении атомов происходит взаимное перекрытие электронных оболочек и между атомами возникают силы электростатического взаимодействия. Перекрытие электронных оболочек сближающихся атомов приводит к обобществлению электронов для обоих ядер. Этот эффект носит название обменного взаимодействия. Силы такого взаимодействия называют обменными силами,а их энергию – обменной энергией. В зависимости от ориентации спинов обобществленных электронов обменное взаимодействие может приводить к образованию либо сил притяжения, либо сил отталкивания. Если спины параллельны, то между сближающимися атомами возникают силы отталкивания и молекула не образуется. При антипараллельных спинах возникают силы притяжения, способствующие образованию молекулы.
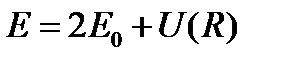

В области перекрытия электронных оболочек возрастает плотность отрицательного заряда, способствующего сближению ядер взаимодействующих атомов, в результате чего молекула становится устойчивой. Обобществленные электроны находятся в области перекрытия оболочек, т.е. на них действуют силы притяжения обоих ядер.
В образовании ковалентной связи участвуют только валентные электроны, а поскольку все атомы стремятся иметь устойчивую оболочку инертного газа, что соответствует минимальной энергии, то количество пар обобществленных электронов соответствует валентности элемента.
На примере Si: Внешняя оболочка содержит 4 валентных электрона, которые образуют 4 электронных облака, направленных (расположенных) по вершинам тетраэдра. Каждый электрон образует ковалентную пару, электроны которой принадлежат обоим взаимодействующим атомам. Поэтому, после образования четырех связей, каждый атом кремния становится обладателем 8 электронов, т.е. валентная оболочка заполняется полностью (кремний становится квази-инертным атомом).
Химическая связь, осуществляемая обобществлёнными электронами, называется ковалентной связью. Ковалентную связь называют еще гомеополярной или валентной
Свойства ковалентной связи:
а) количество связей = количеству валентных электронов;
б) ковалентные связи характеризуются пространственной направленностю (!);
в) насыщенность: спаренные электроны не могут притягиваться к другим электронам (т.е. не возникает обменная энергия). При сближении электрона и спаренных электронов может возникать только отталкивание за счёт перекрытия волновых функций.
· Не всегда возможно различить ковалентные и ионные связи (их преобладание).
· Ковалентную связь в чистом виде можно иметь в молекулах из двух одинаковых атомов (водород), где распределение электронной плотности симметрично относительно ядер. Если атомы различаются, то и результирующее электронное облако в молекуле будет асимметрично, и оба атома уже нельзя считать незаряженными. Ионную связь можно считать предельным случаем гомеополярной связи, когда электронное облако валентных электронов сосредотачивается вокруг одного из ядер.
|
из
5.00
|
Обсуждение в статье: Типы связей в кристаллах (конспективно) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

