 |
Главная |
Изменение концентраций
|
из
5.00
|
Равновесное состояние в системе
H2(г) + I2(г) ®2 HI(г)
характеризуется (для одной и той же температуры) константой равновесия
 .
.
Если, например, в систему добавить водород, т.е. увеличить его концентрацию, то скорость прямой реакции увеличится (в соответствии с законом действующих масс)
 =
=  [H2] [I2],
[H2] [I2], 
 >
>  ,
,
равновесие сместится вправо. Концентрация йодоводорода будет увеличиваться, а концентрация водорода и йода будет уменьшаться.
Процесс будет протекать до тех пор, пока не установится новое равновесие. Новые равновесные концентрации всех компонентов будут другими, но соотношение между ними, определяемое константой равновесия, останется постоянным.
Если в систему ввести дополнительное количество йодоводорода, то скорость обратной реакции увеличится:
 =
=  [HI] 2 ,
[HI] 2 ,  >
>  ,
,
равновесие сместится влево.
Удаление из системы продуктов (или продукта) реакции ведет к смещению равновесия в сторону прямой реакции, а уменьшение концентрации исходных (или исходного) веществ приводит к сдвигу равновесия в направлении обратной реакции.
Изменение давления.
Повышение давления (уменьшение общего объема) вызывает смещение равновесия в направлении уменьшения общего количества молей газообразных веществ, т.е. в направлении, приводящем к понижению давления.
При уменьшении давления (увеличении общего объема) равновесие смещается в сторону увеличения количества молей газообразных веществ, т.е. в направлении, приводящем к возрастанию давления.
Рассмотрим, в каком направлении сместится равновесие в системе
CO(г) + Cl2(г) « COCl2(г),
если при неизменной температуре увеличить давление путем уменьшения объема газовой смеси?
В реакцию вступают 2 моля, а образуется 1 моль газообразных веществ. Прямая реакция при постоянном объеме сопровождается уменьшением давления. Если увеличить общее давление в системе, то согласно принципу Ле Шателье, равновесие сместится в сторону прямой реакции.
Для реакций, протекающих без изменения числа молей газообразных веществ, изменение давления (или общего объема) не влияет на химическое равновесие и равновесный состав продуктов.
Для реакции
H2(г) + I2(г) «2 HI(г)
количество молей газообразных веществ слева и справа от знака равновесия равно. При изменении давления скорости прямой и обратной реакций изменяются одинаково, а их отношение будет оставаться неизменным.
Влияние температуры.
Зависимость константы равновесия от температуры выражается уравнением
 , ,
| (4.22) |
Для экзотермических процессов DНо<0 при увеличении температуры значения Kp уменьшаются, что соответствует смещению равновесия в сторону обратной (эндотермической) реакции.
Например, для реакции синтеза аммиака из азота и водорода
N2(г) + 3H2(г) 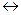 2NH3(г),
2NH3(г),
которая является экзотермической (DНо<0), первое слагаемое в уравнении (4.22) будет положительным. С повышением температуры его абсолютная величина будет уменьшаться. Это приведет к уменьшению Kp независимо от знака ∆Sо. Равновесие смещается в сторону обратного эндотермического процесса разложения аммиака.
Для эндотермическихпроцессов (DНо>0) при увеличении температуры значения Kp увеличиваются, что соответствует смещению равновесия в сторону прямой (экзотермической) реакции.
Например, в реакции
N2O4 (г) « 2 NO2 (г), DН°=57,4 кДж
(DНо>0), т.е. прямая реакция – эндотермическая. Следовательно, первое слагаемое в уравнении (4.22) отрицательно. При увеличении температуры его абсолютная величина уменьшается и независимо от знака ∆Sо константа увеличивается. Равновесие смещается в сторону прямой реакции.
Зная знак DНо, можно сказать, в каком направлении будет изменяться константа равновесия при изменении температуры.
Повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты и охлаждением системы, т.е. в сторону эндотермической реакции.
При понижении температуры равновесие смещается в сторону экзотермической реакции.
|
из
5.00
|
Обсуждение в статье: Изменение концентраций |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

