 |
Главная |
Концентрация растворов
|
из
5.00
|
Концентрацией раствораназывается количество растворенного вещества, содержащееся в определенном количестве или в определенном объеме раствора или растворителя.
В химии наиболее употребимы следующие способы выражения концентрации.
Процентная концентрация. Показывает число граммов растворенного вещества, содержащихся в 100 г раствора. Например, 15%-ный водный раствор соли – это такой раствор, в 100 г которого содержится 15 г соли и 85 г воды.
Молярная концентрация (молярность). Показывает число молей растворенного вещества, содержащихся в 1 л раствора, обозначается моль/л или формулой вещества, заключенной в квадратные скобки. Например, [NaOH]=2 моль/л – это раствор, содержащий 2 моля (или 80 г) гидроксида натрия в одном литре раствора.
Молярная концентрация эквивалентов.Показывает число молей эквивалентов растворенного вещества, содержащихся в 1 л раствора, обозначается Сэк. Например, Сэк H2SO4=0,1моль экв/л – это раствор Н2SO4 , содержащий 0,1 моля эквивалентов серной кислоты (или 4,9 г) в 1 л раствора.
Эквивалентом(обозначается буквой Э) называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Эквивалент кислотыравен молярной массе кислоты, деленной на ее основность, т.е. на число атомов водорода в молекуле кислоты, способных замещаться на металл.
Эквивалент основанияравен молярной массе основания, деленной на валентность металла.
Эквивалент оксидаравен молярной массе оксида, деленной на произведение числа атомов элемента, входящих в состав молекулы, и валентности этого элемента.
Эквивалент соли равен молярной массе соли, деленной на произведение валентности металла и числа атомов металла в ее молекуле.
Например:
моль экв. Н2SO4 (М=98 г/моль) равен 
моль экв. Са(ОН)2 (М=74 г/моль) равен 
моль экв. Al2O3 (М=102 г/моль) равен 
моль экв. Al2(SO4)3 (М=342 г/моль) равен 
Растворы с молярной концентрацией эквивалентов широко применяются при проведении реакций между растворенными веществами. Пользуясь этой концентрацией, легко заранее рассчитать, в каких объемных соотношениях должны быть смешаны растворенные вещества, для того чтобы они прореагировали без остатка. Согласно закону эквивалентов количества веществ, вступающих в реакцию, пропорциональны их эквивалентам:
 .
.
Следовательно, для реакции всегда нужно брать такие объемы растворов, которые содержали бы одинаковое число молей эквивалентов растворенных веществ. При одинаковой молярной концентрации растворов объемы реагирующих веществ пропорциональны их Сэк. Если объемы затрачиваемых на реакцию растворов обозначить через V1 и V2 , а их молярные концентрации эквивалентов через Сэк.1 и Сэк.2, то зависимость между этими величинами выразится отношением:
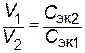
|
или  , ,
| (5.2) |
т.е. объемы реагирующих веществ обратно пропорциональны молярным концентрациям их эквивалентов.
На основании этих зависимостей можно не только вычислить необходимые для проведения реакций объемы растворов, но и по объемам затраченных на реакцию растворов находить их концентрации.
Титр. Показывает количество граммов растворенного вещества, содержащееся в 1 мл раствора. Обозначается буквой Т.
Зная титр раствора, легко вычислить его молярную концентрацию эквивалента, и наоборот:


Моляльная концентрация (моляльность). Показывает число молей растворенного вещества, содержащееся в 1000 г растворителя, обозначается Сm :
 , ,
|  (5.3) (5.3)
|
где m – количество растворенного вещества,  – количество растворителя, г; M – мольная масса растворенного вещества, г/моль.
– количество растворителя, г; M – мольная масса растворенного вещества, г/моль.
Законы Рауля
Каждой жидкости при данной температуре соответствует определенное давление насыщенного пара р0. С повышением температуры р0 увеличивается. При растворении в жидкости какого-либо нелетучего вещества давление насыщенного пара растворителя над раствором становится ниже, чем над чистым растворителем при той же температуре. Причем понижение давления пропорционально концентрации раствора.
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества (закон Рауля):

| (5.4) |
где p0– давление насыщенного пара над чистым растворителем;
p – давление насыщенного пара растворителя над раствором; N – мольная доля растворенного вещества; n1 – число молей растворенного вещества; n2 – число молей растворителя.
Мольная доля (Ni) равна отношению числа молей данного вещества (ni) к сумме числа молей всех веществ (включая растворитель) в растворе:

Понижение давления насыщенного пара растворителя над раствором нелетучего вещества приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем.
Согласно закону Рауля, давление водяного пара над водным раствором ниже, чем над водой.
Температура кипения жидкости Ткип – это температура, при которой давление насыщенного пара ее достигает атмосферного давления; для воды это 100°С (при давлении 101,3 кПа или 1,013∙105 Н/м2). Так как над раствором давление насыщенного пара растворителя ниже, то для того чтобы раствор закипел, его надо нагреть до более высокой температуры, чем чистый растворитель.
|
из
5.00
|
Обсуждение в статье: Концентрация растворов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

