 |
Главная |
Примеры решения типовых задач. Пример 1. Рассчитайте титр (г/мл), молярную (моль/л) и молярную концентрацию
|
из
5.00
|
Пример 1. Рассчитайте титр (г/мл), молярную (моль/л) и молярную концентрацию эквивалентов (моль экв/л) 17,5%-ного раствора серной кислоты, плотность которого r=1,12 г/см3.
Решение.
1. Определяем весовое количество серной кислоты, содержащееся в 1 л 17,5 %-ного раствора
а) находим массу 1 литра (1000 мл) раствора:
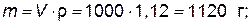
б) рассчитываем весовое количество серной кислоты, содержащееся в 1120 г раствора:
в 100 г раствора содержится 17,5 г H2SO4;
в 1120 г раствора – х г H2SO4,

2. Определяем титр раствора; для этого необходимо весовое количество кислоты, содержащееся в известном объеме раствора, разделить на объем раствора, выраженный в миллилитрах:
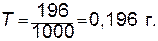
3. Рассчитываем молярную концентрацию раствора; для этого необходимо весовое количество кислоты, содержащееся в 1 л раствора, разделить на молярную массу (MH2SO4), 98 г/моль:

4. Находим молярную концентрацию эквивалентов раствора H2SO4; для этого необходимо весовое количество кислоты, содержащееся в 1 л раствора (196 г), разделить на эквивалентную массу (Э H2SO4).
Эквивалентная масса H2SO4 равна ее молярной массе, деленной на количество атомов водорода:


Следовательно: 
Молярную концентрацию эквивалентов также можно рассчитать, используя титр (Т) и эквивалентную массу (Э):
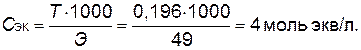
Ответ: Т =0,196 г/мл; [H2SO4]=2 моль/л; Cэк=4 моль экв/л.
Пример 2. Рассчитайте, сколько миллилитров 96%-ного раствора H2SO4 (r=1,84 г/см3) потребуется для приготовления 1л ее раствора с молярной концентрацией, равной 0,5 моль/л.
Решение.
1. Рассчитываем весовое количество H2SO4, необходимое для
приготовления 1 л раствора с молярной концентрацией, равной 0,5 моль/л (молярная масса серной кислоты равна 98 г/моль):
в 1000 мл 0,5 молярного раствора содержится 98∙0,5=49 г Н2SO4.
2. Определяем весовое количество исходного (96%) раствора,
содержащего 49 г Н2SO4:
в 100 г раствора содержится 96 г H2SO4,
в х г раствора – 49 г Н2SO4.

3. Находим необходимый объем исходного раствора, разделив весовое количество раствора на его плотность (r):

Ответ: для приготовления 1 л раствора серной кислоты с молярной концентрацией 0,5 моль/л необходимо 27,74 мл 96%-го раствора Н2SO4.
Пример 3. Рассчитайте, сколько граммов этилового спирта (С2Н5ОН) и воды необходимо взять для приготовления 1000 граммов раствора, незамерзающего до –30оС? Криоскопическая константа воды Kк равна 1,86кг  К
К  моль-1.
моль-1.
Решение.
1. Используя следствие из закона Рауля

находим отношение

Молярная масса С2Н5ОН равна 46 г/моль. Учитывая, что

определяем количество этилового спирта, исходя из соотношения 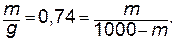 m=425,3 г.
m=425,3 г.
Количество воды, необходимое для приготовления раствора равно: g=1000–425,3=574,7 г.
Ответ: m=425,5 г, g=574,5 г.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
|
из
5.00
|
Обсуждение в статье: Примеры решения типовых задач. Пример 1. Рассчитайте титр (г/мл), молярную (моль/л) и молярную концентрацию |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

