 |
Главная |
Способы получения альдегидов и кетонов
|
из
5.00
|
Альдегиды и кетоны могут быть получены окислением или дегидрированием спиртов. Эти реакции подробно рассмотрены в § 17. Ещё раз отметим, что при окислении или дегидрировании первичных спиртов могут быть получены альдегиды, а вторичных спиртов — кетоны:

Реакция Кучерова (гидратация алкинов) рассмотрена в § 13. Напомним, что из ацетилена в результате реакции получается уксусный альдегид, из гомологов ацетилена — кетоны:

При нагревании кальциевых или бариевых солей карбоновых кислот образуется кетон и карбонат металла:

Карбоновые кислоты.
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп-COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Классификация
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
1. ароматические (бензойная кислота)
2. алифатические (в том числе предельные (капроновая кислота) и непредельные (акриловая кислота))
3. алициклические (хинная кислота)
4. гетероциклические (никотиновая кислота).
По числу карбоксильных групп кислоты могут быть:
1. одноосновными (уксусная кислота)
2. двухосновными (щавелевая кислота)
3. многоосновными (лимонная кислота).
При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
Получение
Лабораторные методы получения предельных кислот
Окислительные методы
1. Окисление спиртов (реактивом Джонса — раствором оксида хрома(VI) в разбавленной серной кислоте и ацетоне или перманганатом калия в кислой или нейтральной среде)[4]:

1. Окисление альдегидов (используются те же реагенты, что и в случае спиртов, а также оксид серебра(I)):

1. Окисление алкинов соединениями Tl (III)[5]:

1. Окислительная деструкция алкенов — окисление алкенов смесью перманганата калия и периодата натрия в водном ацетоне в нейтральной среде (реакция идёт в две стадии — на первой перманганат окисляет алкен до диола, на второй периодат окисляет диол до кислоты, избыток периодата окисляет Mn+4 до Mn+7, так что перманганата требуется лишь каталитическое количество)[4]:

1. Окисление алкилбензолов и других алкиларенов — самый распространённый способ получения ароматических карбоновых кислот. При этом первичные и вторичные алкильные группы окисляются до карбоксильной. В качестве окислителя применяются водный щелочный, нейтральный или солюбилизированный краун-6-эфиром в безоле (пурпурный бензол) растворы перманганата калия, кислый бихромата натрия или водная азотная кислота[4][5]:

Гидролиз.
Гидролиз тригалогеналканов

1. Гидролиз сложных эфиров

1. Гидролиз нитрилов и амидов


Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу (амид легко гидролизируется в присутствии H2O2 в щелочной среде или нитрит-иона в кислой); удобный лабораторный метод (если нитрил доступен).
Карбоксилирование
1. Карбоксилирование металлорганических соединений (в основном реактивов Гриньяра и литийорганических соединений):


1. Карбоксилирование илидов фосфора[5]:

1. При помощи диизопропиламида лития и других аналогичных амидов можно непосредственно вводить группу -CH2COOH:

Синтез ароматических кислот
Имеется несколько специфических методов применяемых только для синтеза ароматических кислот.
1. Реакция Кольбе-Шмитта — карбоксилирование фенолятов металлов (в промышленности эта реакции используется для синтеза салициловой кислоты)[5]:

1. Реакция Фриделя-Крафтса с использованием фосгена[5].
1. Реакция Фон-Рихтера — ароматическое нитросоединение при реакции с цианидом калия карбоксилируется в орто положении к нитрогруппе:

Другие методы
1. Реакция Арндта-Эйстерта — превращение карбоновой кислоты в ближайший гомолог с использованием диазометана:
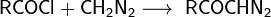

Используется для получения высших гомологов кислот из низших.
1. Серия реакций для превращения в низший гомолог:

Физические свойства
Димеры карбоновых кислот
Низшие кислоты с числом атомов углерода до 3 — легкоподвижные бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом. Кислоты с большим количеством атомов углерода — твёрдые вещества, нерастворимые в воде. Плотность муравьиной и уксусной кислот больше единицы, остальных — меньше. Температура кипения возрастает по мере увеличения молекулярной массы, при одном и том же числе углеродных атомов кислоты нормального строения кипят при более высокой температуре, чем кислоты изостроения[6].
У кислот нормального строения есть закономерность: температура плавления кислот с чётным числом атомных углеродов выше, чем температура плавления соседних с нечётным числом. Это объясняется расположением метильной и карбоксильной групп — в кислотах чётного ряда они по разные стороны от оси молекулы, а нечётного — по одну. Благодаря более симметричному строению молекулы кислоты с чётным числом атомов углерода сильнее взаимодействуют между собой в кристаллической решётке и её труднее разрушить при нагревании[6].
Карбоновые кислоты кипят при значительно более высоких температурах, чем спирты. Их молекулы ассоциированы намного сильнее вследствие того что связи  в них в большей степени поляризованы по типу
в них в большей степени поляризованы по типу  . Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом состоянии карбоновые кислоты существуют в основном в виде циклических димеров[2][5], а в жидком происходит и линейная ассоциация[7]. Даже в парах они димеризированы[6]. Две водородные связи довольно прочны, энергия димеризации для муравьиной кислоты составляет 14 ккал/моль[4].
. Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом состоянии карбоновые кислоты существуют в основном в виде циклических димеров[2][5], а в жидком происходит и линейная ассоциация[7]. Даже в парах они димеризированы[6]. Две водородные связи довольно прочны, энергия димеризации для муравьиной кислоты составляет 14 ккал/моль[4].
Строение
Карбоксильная группа планарна, длина связи C=O в различных кислотах составляет 0,118-0,126 нм, связи C-O — 0,121-0,137 нм — наблюдается выравнивание длин связей углерод-кислород при диссоциации[8]. Карбон карбоксильной группы находится в состоянии sp2-гибридизации, угол O-C-O в различных кислотах составляет 118—122,5°. Дипольный момент карбоксильной группы составляет ~5,4·10−30 Кл·м. При диссоциации образуется стабилизированный сопряжением анион. В нём обе связи C-O равноценны и составляют 0,127-0,129 нм[8].
Длина водородной связи в димере 0,26 нм[5].
Кислотные свойства
Карбоновые кислоты проявляют типичные кислотные свойства — при реакции с металлами, их оксидами или их осно́вными гидроксидами дают соли соответствующих металлов, могут вытеснять более слабую кислоту из её соли и сами могут быть вытеснены более сильной кислотой:



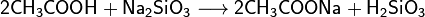
Соли карбоновых кислот в воде подвергаются гидролизу и имеют щелочную реакцию.
Восстановление
Карбоновые кислоты восстанавливаются до первичных спиртов с помощью литийалюминийгидрида при кипячении в тетрагидрофуране или дибораном в более мягких условиях, кроме того при этом не восстанавливаются группы NO2, COOR и CN[4]:

Избирательное восстановление до альдегидов достигается обработкой Li в метиламине (образующийся альдегид защищается растворителем в виде азометина)[5]:

Галогенирование
Радикальное галогенирование кислот хлором при облучении УФ-светом при 300—400 °C идёт неселективно и приводит к трудноразделяемой смеси изомеров. Региоселективное α-галогенирование достигается по методу Гелль-Фольгарда-Зелинского — кислоту обрабатывают хлором или бромом в присутствии красногофосфора или соответствующих хлорида или бромида фосфора(III).[4]
Реакции нуклеофильного замещения у ацильного атома углерода
Для реакций нуклеофильного замещения у sp2-гибридного ацильного атома углерода реализируется двухстадийный механизм присоединения-отщепления. В первой стадии нуклеофильный агент присоединяется к карбоновой кислоте (или её производному) с образованием заряженного (для анионного нуклеофильного агента) или незаряженного (для нейтрального) тетраэдрического интермедианта. Во второй стадии от этого интермедианта отщепляется в виде аниона или нейтральной молекулы уходящая группа Z и образуется конечный продукт присоединения. Реакция обратима, однако если Z- и Nu- сильно различаются по своей основности и нуклеофильности, она становится необратимой[4].
1. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):

Выделение воды идёт за счёт гидроксила карбоксильной группы кислоты и атома водорода гидроксила спирта. В то же время при применении кислоты, меченной 18O по карбонилу наблюдалась потеря активности. Это свидетельствует о том, что в реакции затрагивается и карбонильный атом кислорода[8].
1. Реакция с литийорганическими соединениями — важный метод получения кетонов[5]:
 '
'
1. С магнийорганическими соединениями карбоновые кислоты реагируют только в жёстких условиях, образуя, как правило, третичные спирты[5].
1. Под действием SOCl2 и PCl5 карбоновые кислоты превращаются в соответствующие хлорангидриды:

1. Ангидриды можно получить дегидратацией кислот, однако этот метод применим не ко всем кислотам (так в основном получают лишь ангидриды сильных карбоновых кислот[4]). Их получают в основном реакцией галогенангидридов с солями карбоновых кислот. Таким образом получают и смешанные ангидриды[6]:

Двухосновные янтарная и глутаровая кислоты при нагревании легко превращаются во внутренние ангидриды[7].
Кетены являются внутренними ангидридами кислот. Их получают в основном элиминированием хлорангидридов кислот. Кетен можно получить пиролизом уксусной кислоты и уксусного ангидрида[5][8].
Получение амидов и нитрилов
При нагревании аммонийных солей карбоновых кислот образуются их амиды:

При нагревании амидов с P2O5 отщепляется вода и образуются нитрилы кислот:

Декарбоксилирование
Реакция Бородина-Хунсдиккера — серебряная соль карбоновой кислоты при нагревании с раствором брома в CCl4 превращается в алкилгалогенид[4]:

При окислении-декарбоксилировании тетраацетатом свинца в зависимости от условий образуются алканы, алкены или эфиры уксусной кислоты:

Карбокатион, отщепляя протон превращается в алкен, а захватывая ацет-анион — в эфир[4].
Реакция Кольбе — электрохимическая реакция получения углеводородов из карбоновых кислот[4]:

Реакция Шмидта — при реакции с азотистоводородной кислотой образуются амины (промежуточным продуктом является изоцианат) и выделяется углекислый газ:

При нагревании в присутствии в присутствии гидроксида бария карбоновые кислоты (а также их кальциевые и бариевые соли) декарбоксилируются с образованием симметрических кетонов. Именно эта реакция долгое время была основным способом получения ацетона[9]:

Примером внутримолекулярной реакции данного типа является получение циклопентанона пиролизом адипиновой кислоты и циклогексанона пиролизом пимелиновой кислоты в присутствии солей бария или кальция (циклизация Ружички)[7].
Простейшие двухосновные кислоты (щавелевая и малоновая) термически неустойчивы и легко декарбоксилируются[7]:

Муравьиная кислота

проявляет общие свойства кислот, так. как имеет функциональную карбоксильную группу. Реакция солеобразования доказывает кислотные свойства муравьиной кислоты. При этом образуются соли — формиаты.

Как и все карбоновые кислоты, муравьиная кислота образует сложные эфиры.
Реакция этерификации:

От остальных карбоновых кислот муравьиная кислота отличается тем, что карбоксильная группа в ней связана не с углеводородным радикалом, а с атомом водорода. Поэтому муравьиную кислоту можно рассматривать и как кислоту, и как альдегид:

Подобно альдегидам, муравьиная кислота может окисляться:

Муравьиная кислота дает реакцию «серебряного зеркала»:

Муравьиная кислота разлагается при нагревании:

Щавелевую кислоту нельзя считать гомологом муравьиной кислоты, так как щавелевая кислота является двухосновной кислотой

муравьиная кислота относится к гомологическому ряду одноосновных карбоновых кислот

|
из
5.00
|
Обсуждение в статье: Способы получения альдегидов и кетонов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

