 |
Главная |
Тема 2. Классы неорганических соединений
|
из
5.00
|
По составу все вещества делятся на простые и сложные. Простыми называются вещества, состоящие из атомов одного элемента (водород – Н2, кислород - О2, натрий – Na и т.д.). Сложными называются вещества, состоящие из атомов нескольких химических элементов. Сложные неорганические вещества принято делить на 4 основных класса: оксиды , кислоты, основания, соли.
Оксиды – это сложные вещества, состоящие из атомов двух элементов, один из которых кислород. Оксиды делятся на несолеобразующие (CO, NO, N2O) и солеобразующие. Солеобразующие оксиды в свою очередь подразделяются на основные, кислотные и амфотерные.

Основные оксиды образованы металлами с низкой валентностью и им соответствуют основания. Например, оксиды Na2O, CaO, CuO являются основными оксидами и им соответствуют основания – NaOH, Ca(OH)2, Cu(OH)2. Характерным свойством основных оксидов является их реакция с кислотами, при этом образуется соль и вода.
CuO + 2HCl = CuCl2 + 2H2O
Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой, образуя основания.
CaO + H2O = Ca(OH)2
Основные оксиды могут взаимодействовать и с кислотными оксидами, при этом образуются соли.
CaO + CO2 = CaCO3
Кислотные оксиды образованы неметаллами (P2O5, CO2, SO3) и металлами, когда они про являют высокую валентность (V, VI, VII) (V2O5,CrO3, Mn2O7). Кислотным оксидам соответствуют кислоты, которые можно получить при непосредственном взаимодействии оксида с водой. Например:
SO3 + H2O = H2SO4
Mn2O7 + H2O = 2HMnO4
Характерным свойством кислотных оксидов является их реакция со щелочами, в результате образуется соль и вода.
2NaOH + SO3 = Na2SO4 + H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
Амфотерные оксиды образованы металлами с переходными свойствами и могут проявлять как кислотные , так и основные свойства, т.е.при взаимодействии с кислотами ведут себя как основные оксиды, а при взаимодействии с основаниями – как кислотные оксиды. К амфотерным оксидам относятся: ZnO, Al2O3, PbO, BeO,Cr2O3 и др. Пример двойственности свойств оксида цинка:
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O
В первой реакции оксид цинка ведет себя как основной оксид, в образовавшейся соли он является катионом, а во второй реакции ZnO проявляет свойства кислотного оксида, в соли (Na2ZnO2 ) он входит в состав кислотного остатка.
Основания – это сложные вещества, состоящие из атома металла, связанного с некоторым числом гидроксогрупп (OH). Число гидроксильных групп зависит от валентности металла и называется атомностью основания. Например, NaOH –одноатомное основание, а Ba(OH)2 – двухатомное. Основания – это гидраты основных оксидов, поэтому их называют гидроксидами. Основания, растворимые в воде, называют щелочами (KOH, NaOH, Ba(OH)2). Они образованы щелочными и щелочно-земельными металлами. Характерной реакцией оснований является реакция с кислотами (реакция нейтрализации)
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Они реагируют также с кислотными и амфотерными оксидами (см. ранее) и с солями.
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4.
Так получают нерастворимые основания. Нерастворимые основания при нагревании разлагаются на оксид и воду.
t
Cu(OH)2 = CuO + H2O
Амфотерные основания (или амфотерные гидроксиды) проявляют двойственные свойства: они реагируют с кислотами как обычные основания, и со щелочами. В последней реакции они ведут себя как слабые кислоты.
2Cr(OH)3 + 3 H2SO4 = Cr2(SO4)3 + 6H2O
Cr(OH)3 + 3NaOH = Na3CrO3 + 3 H2O
Кислоты – это сложные вещества, состоящие из атомов водорода, способного замещаться на металл и кислотного остатка. Число атомов водорода в молекуле кислоты называют основностью кислоты, так HNO3 – одноосновная кислота, H2SO4 и H2SO3 – двухосновные кислоты. В зависимости от состава кислоты делятся на кислородсодержащие (H2SO4) и бескислородные (HCl, H2S). Кислородсодержащие кислоты являются гидратами кислотных оксидов, их можно получить, растворяя оксид в воде
P2O5 + 3H2O = 2H3PO4
У бескислородных кислот соответствующих оксидов нет. Их получают растворением в воде в соответствующих водородных соединений. HCl – хлороводородная или соляная кислота, ее получают растворением в воде газообразного хлороводорода. Характерными реакциями являются взаимодействие с металлами (а), основаниями (б) и солями(в).
а) Mg + 2HCl = MgCl2 + H2
б) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
в) AgNO3 + HCl = AgCl + HNO3
Соли – это сложные вещества, состоящие из атомов металла и кислотного остатка, их можно рассматривать как продукт полного или частичного замещения атомов водорода в молекуле кислоты на металл. Соли бывают средние, кислые и основные.
Средние или нормальные соли, например Na2SO4, Ca3(PO4)2, MgCO3 – это продукт полного замещения атомов водорода в молекуле соответствующей кислоты.
Кислые соли, например NaHSO4, CaHPO4, Mg(HCO3)2 , получены при частичном замещении атомов водорода в молекуле кислоты. Кислые соли образуют только двух- и трех основные кислоты.
Основные соли можно рассматривать как продукты неполного замещения гидроксогрупп в молекуле основания, например (AlOH)SO4, (MgOH)Cl. Основные соли образуют только многоатомные основания.
Соли взаимодействуют с металлами, кислотами, основаниями и между собой. Частично эти реакции уже рассматривались.
AgNO3 + NaCl = AgCl + NaNO3
Cтруктурные формулы оксидов, оснований, кислот и солей.
В структурных формулах показывают порядок соединения атомов в молекуле. При написании формул нужно учитывать валентность атомов. Валентность – это способность атомов образовывать определенное число химических связей. Валентность определяется электронным строением атома.
Оксиды. В молекулах оксидов атомы кислорода между собой не связаны.

Основания.
NaOH Na—O—H
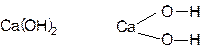
Кислоты. HCl H—Cl
В кислородсодержащих кислотах атомы водорода соединяются с центральным атомом через кислород.

Соли. В солях атомы водорода полностью или частично замещены металлом по сравнению с соответствующей кислотой.

Названия оксидов, оснований, кислот, солей.
Название оксидов складывается из слова «оксид» и названия элемента. Например:Al2O3 – оксид алюминия. Если элемент образует несколько оксидов, то после названия элемента указывают его валентность. Например: SO2 – оксид серы(IV), SO3 – оксид серы (VI).
Название основания складывается из двух слов: «гидроксид» и названия элемента, если валентность элемента переменная, то она указывается. Например: Fe(OH)2 –гидроксид железа(II), Fe(OH)3 – гидроксид железа(III).
Название бескислородных кислот складывается из названия соединения элемента с водородом. Например: HCl – хлороводородная кислота, H2S – сероводородная кислота. Названия кислородсодержащих кислот образуются от названия элемента с окончанием «ная» (если валентность или степень окисления центрального атома максимальная) или «истая» (если валентность или степень окисления центрального атома более низкая). Например: H2SO4 – серная кислота (степень окисления серы +6), а H2SO3 – сернистая кислота (степень окисления серы +4).
Названия солей образуются от латинского названия элемента и имеют окончание «ат» (если степень окисления центрального атома в кислоте максимальная), «ит» (если степень окисления более низкая) «ид» (если соль образована бескислородной кислотой).В кислых солях, содержащих атом (атомы) водорода к названию соли добавляется частица «гидро», а в основных солях, содержащих группу «ОН» — частица «гидроксо». Например: Na2SO4 – сульфат натрия; NaHSO4 – гидросульфат натрия; MgCl2 – хлорид магния; (MgOH)Cl – хлорид гидроксомагния; Na2SO3 – сульфит натрия;
Контрольные задачи
Какие вещества требуются для превращений? Напишите соответствующие реакции.
- Cr2O3 => CrCl3 => Cr(OH)3 =>Na3CrO3
- Na2CO3 => CO2 => H2CO3 => CaCO3
- CuO =>CuSO4 => Cu(OH)2 => CuO
- P =>P2O5 => H3PO4 => Mg3(PO4)2 => MgHPO4
- Zn => ZnCl2 => Zn(OH)2 => Na2ZnO2
- CaCO3 => Ca(HCO3)2 => Ca(OH)2 => (CaOH)2SO4
- Zn => Zn SO4 => Zn(HSO4)2 => ZnCO3 =>CO2
- CO2 => CaCO3 => Ca(HCO3)2 => Ca3(PO4)2
- Al => Al2(SO4)3 => Al(OH)3 => AlOH(NO3)2
- SO2 => SO3 => H2SO4 => KHSO4
- Напишите химическую и структурную формулы сульфата железа (III).
- Напишите химическую и структурную формулы гидросульфита алюминия.
- Напишите химическую и структурную формулы карбоната гидроксомагния.
- Напишите химическую и структурную формулы гидрофосфата цинка.
- Напишите химическую и структурную формулы сульфида гидроксохрома (III).
- Напишите химическую и структурную формулы нитрата гидроксосвинца (II).
- Напишите химическую и структурную формулы гидрокарбоната калия.
- Напишите химическую и структурную формулы фосфата гидроксоцинка.
- Напишите химическую и структурную формулы нитрита гидроксобария.
- Напишите химическую и структурную формулы дигидрофосфата меди.
|
из
5.00
|
Обсуждение в статье: Тема 2. Классы неорганических соединений |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

