 |
Главная |
ЖЁСТКОСТЬ ВОДЫ И МЕТОДЫ ЕЁ УСТРАНЕНИЯ
|
из
5.00
|
14.1. Жёсткость воды
Жёсткость воды — совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей металлов, главным образом, кальция Са2+ и магния Mg2+ (так называемых «солей жёсткости»). Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния (Са(НСО3)2; Mg(НСО3)2), и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).Общая жёсткость воды равна сумме временной (карбонатной) и постоянной (некарбонатной) жёсткости.
В системе СИ жёсткость измеряется в моль/м3. На практике пользуются градусами жёсткости, выражают жёсткость в миллиграммах эквивалентов на литр, а также в миллимоль эквивалентов на литр. 1°Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля на литр (1°Ж = 1 мг-экв/л = 1/2 ммоль-экв/л). По величине общей жёсткости различают воду мягкую (до 2°Ж), средней жёсткости (2-10°Ж) и жёсткую (более 10°Ж).
В данном пособии за размерность жёсткости воды принят 1 мг-экв/л (часто эквивалент пропускают и выражают жёсткость воды в ммоль/л), который выражают суммой миллимоль (ммоль) эквивалентов ионов Са2+ и Mg2+содержащихся в 1 литре воды. Один миллимоль жёсткости отвечает содержанию 20,04 мг/л Са2+ и 12,16 мг/л Mg2+.
Жёсткость воды может быть рассчитана по формуле, представленной в общем виде:
 , (1)
, (1)
где Ж – жёсткость воды, ммоль-экв/л; mi – масса катионов (или соответствующих солей), мг; Мэк i – молярная масса эквивалентов катионов (или соответствующих им солей), мг/ммоль; V – объём воды, л.
1. Определение жёсткостиводы по массе содержащихся в ней солей.
Пример 1.Рассчитайте общую жёсткость воды (ммоль/л}, если в 0,20 л воды содержится 32,42 мг гидрокарбоната кальция Са(НСО3)2; 1,46 мг гидрокарбоната магния Mg(HCО3)2; 22,20 мг хлорида кальция CaCl2 и 4,75 мг хлорида магния MgCl2.
Решение. Общая жёсткость воды может быть рассчитана по формуле (1)

 .
.
Массы солей и объём воды известны по условию задачи. Находим молярные массы эквивалентов солей. Молярная масса эквивалентов соли равна молярной массе соли, деленной на эквивалентное число Z. Для всех солей Z равно 2.
Поэтому:
Mэк Са(НСО3)2 = М Са(НСО3)2/2 = 162,11/2 - 81,05 мг/ммоль;
Mэк Mg(HCO3)2 = M Mg(HCO3)2/2 = 146,34/2 = 73,17 мг/ммоль;
Mэк СаСl2 = М СаС12/2 = 110,99/2 = 55,49 мг/ммоль;
Mэк MgCl2 =M MgCl2/2 - 95,21/2 = 47,60 мг/ммоль.
Подставляя в формулу массы, молярные массы эквивалентов солей и объём воды, рассчитываем общую жёсткость воды:

=2,0 + 0,1 + 2,0 + 0,5 = 4,6 ммоль/л.
Пример 2. Вычислите временную жёсткость воды, зная, что в 500 л её содержится 162,1 г Са(НСО3)2.
Решение. Временную жёсткость воды можно найти по формуле (1), подставив в неё массу, молярную массу эквивалентов Са(НСО3) 2 и объём воды. Молярная масса эквивалентов Са(НСОз)2 равна 81,05 мг/ммоль (см. пример 1), масса этой соли равна 162100 мг, объем воды 500 л. Следовательно,
 .
.
2. Определение содержания солей в воде по жёсткости воды
Пример 3. Сколько граммов СаСl2 содержится в 100 л воды, если жесткость воды, вызванная этой солью, равна 2,5 ммоль/л?
Решение. Массу соли СаСl2 можно найти по формуле (1). А именно:
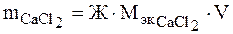 .
.
Подставляя в формулу жёсткость воды, молярную массу эквивалентов CaCl2 (см. пример 1) и объем воды, получаем:
M CaCl2 = 2,5 · 55,49 · 100 = 13872,5мг или 13,8725 г.
3.Определение временной (карбонатной) жёсткости воды по объёму соляной кислоты, пошедшей на её титрование
Самым простым методом определения жёсткости воды является метод титрования. Для определения временной жёсткости воды используют стандартный раствор соляной кислоты. При этом происходит следующая реакция:
Ме(НСО3) 2 + 2 НС1 = МеС12 + 2 Н2О + 2СО2,
где Me – Са2+, Mg2+, Fe2+.
Согласно закону эквивалентов, количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. Отсюда:
 , (2)
, (2)
где Сэк1 и V1 – соответственно молярная концентрация эквивалентов вещества(моль/л) и объём (л) первого раствора; Cэк2 и V2 – молярная концентрация эквивалентов вещества (моль/л) и объём (л) второго раствора.
Пример 4. Определите временную жёсткость воды, если на титрование 5 · 10–2 л воды, содержащей гидрокарбонат кальция, израсходовано 1,44 · 10–3 л 1,15н раствора HCl.
Решение. По условию задачи молярная концентрация эквивалентов Сa(HCO3)2 неизвестна. Обозначим её через х.Подставляя значения в формулу (2), получаем:
х · 5· 10–2 = 1,44 · 10–3 · 0,15.
Отсюда:
 н.
н.
Таким образом, молярная концентрация эквивалентов Сa(HCO3)2 равна 0,004н, что соответствует содержанию Сa(HCO3)2 0,004 моль/л или 4 ммоль/л. Следовательно, временная жёсткость воды составляет 4 ммоль/л.
Пример 5. Чему равна временная жесткость воды, если на титрование 100 мл этой воды, содержащей гидрокарбонат железа (II), израсходовано 5,75 мл 0,07 н раствора HCl.
Решение. Данная задача решается аналогично тому, как это показано в примере 5, предварительно переведя объёмы растворов в литры, т.е. V1 = 0,1 л H2O; V2 = 5,75 · 10–3 л HCl. Подставляя значения в формулу (2), получаем:
х · 0,1 = 5,75 · 10–3 · 0,07.
Отсюда:
 н.
н.
Молярной концентрации эквивалентов Fe(HCO3)2 соответствует содержание этой соли, равной 4 · 10–3 моль/л или 4 ммоль/л.
Следовательно, жёсткость воды 4 ммоль/л.
14.2. Методы умягчения воды
Для умягчения воды применяют методы осаждения и ионного обмена. Путем осаждения катионы Са2+ и Mg2+ переводят в малорастворимые соединения выпадающие в осадок. Это можно достичь кипячением или химическим путем – введением в воду, например, соды Nа2СО3, гашёной извести Са(ОН)2 и т.д. При кипячении устраняется только временная (карбонатная) жёсткость по реакции:
Сa(HCO3)2  CaCO3¯ + CO2 + H2O.
CaCO3¯ + CO2 + H2O.
Mg(HCO3)2  Mg(OH)2¯ + CO2.
Mg(OH)2¯ + CO2.
При разложении Mg(HCO3)2 образуется Mg(OH)2, а не MgCO3 так как 
Метод химического умягчения основан на добавлении в воду кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в нерастворимый карбонат:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому легко отделяются механическим фильтрованием.
Метод ионного обмена основан на использовании ионообменной гранулированной смолы, которая поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, смола отдаёт ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование.
4.Определение массы реагента, необходимого для устранения жёсткости воды.
Пример 6. Сколько граммов соды Nа2СО3 надо прибавить к 150 л воды, чтобы устранить жёсткость, равную 5 ммоль/л?
Решение. В 150 л воды содержится 150 · 5 = 750 ммоль/л солей, вызывающих жёсткость воды. По закону эквивалентов для устранения этой жёсткости необходимо добавить такое же количество вещества эквивалентов, умягчающих воду, т.е. 750 ммоль Na2CО3.
Для нахождения вещества в граммах количество вещества эквивалентов умножают на молярную массу эквивалентов этого вещества. В данном случае эквивалентное число Na2CO3 равно двум, и молярная масса эквивалентов Na2CО3 будет
МэкNа2СО3 = М Nа2СО3/2 = 106/2 = 53 мг/ммоль.
Находим массу Na2CO3:
m Na2CO3 = nэк Na2CO3 Мэк Na2CO3 = 750 · 53 = 39750 мг или 39,75 г.
Эту же задачу можно решить, используя формулу (1). Для этого необходимо помнить, что по закону эквивалентов массы реагирующих веществ пропорциональны их молярным массам эквивалентов. Поэтому в формулу (1) вместо молярной массы эквивалентов солей, вызывающих жёсткость, можно подставить молярную массу эквивалентов веществ, необходимых для устранения этой жёсткости, чтобы найти их массу. В данном случае:
m Na2CO3 = Ж · МэкNa2СО3 · V.
Подставляя значения Ж, МэкNa2CO3 и V, получаем:
m Na2CO3 = 5 ·53 · 150 = 39750 мг или 39,75 г.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
261. Что понимается под жёсткостью воды? В чём измеряется жёсткость воды? Вода объемом 1 л содержит 38,0 мг гидрокарбоната кальция и 19,6 мг сульфата магния. Чему равна общая жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 0,8 ммоль/л.
262. Почему необходимо устранять избыточную жёсткость воды? Чем опасна такая вода? Приведите примеры. Чему равна жёсткость воды, содержащая 0,01 моль/л хлорида кальция? К какой группе жёсткости относится такая вода?
Ответ: 20 ммоль/л.
263. Чем обусловлена постоянная жёсткость воды? Какие существуют химические способы устранения постоянной жёсткости воды? Напишите уравнения соответствующих реакций. Чему равна постоянная жесткость воды, если в 2,5 л ее содержится 40 мг сульфата кальция? К какой группе жёсткости относится такая вода?
Ответ: 0,23 ммоль/л.
264. Из чего складывается общая жёсткость воды? Ответ поясните. Чему равна общая жёсткость воды, если в 3,4 л ее находится 57 мг гидрокарбоната магния и 33 мг сульфата кальция? К какой группе жёсткости относится такая вода?
Ответ: 0,37 ммоль/л.
265. Чем обусловлена временная жёсткость воды? Какими методами можно устранить избыточную временную жёсткость воды? Напишите необходимые уравнения химических реакций. При кипячении 0,25 л воды, содержащей только гидрокарбонат кальция, в осадок выпадает 4мг карбоната кальция. Чему равна временная жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 0,32 ммоль/л.
266. Чем обусловлена постоянная жёсткость воды? Какие существуют химические способы устранения постоянной жёсткости воды? Напишите уравнения соответствующих реакций. Сколько граммов сульфата магния содержится в 150 л воды, если жёсткость воды, вызванная этой солью равна 4,7 ммоль/л? К какой группе жёсткости относится такая вода?
Ответ: 42,441 г.
267. Чем обусловлена временная жёсткость воды? Какими методами можно устранить избыточную временную жёсткость воды? Напишите необходимые уравнения химических реакций. При кипячении 0,5 л воды, содержащей только гидрокарбонат железа (II). В осадок выпадает 8 мг карбоната железа (II). Чему равна временная жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 0,28 ммоль/л.
268. Что такое титрование? На каком законе основан метод титрования? Дайте формулировку этого закона. На титрование 25 мг воды израсходовано 2,4 мл 0,1н раствора НС1. Чему равна карбонатная жёсткость воды? К какой группе жёсткости относится такая вода? К какой группе жёсткости относится такая вода?
Ответ: 9,6 ммоль/л.
269. Из чего складывается общая жёсткость воды? Ответ поясните. Какими методами можно устранить избыточную общую жёсткость воды? Напишите соответствующие уравнения реакций. Для умягчения 200 л воды потребовалось 12,72 г карбоната натрия. Чему равна жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 1,2ммоль/л.
270. Чем обусловлена временная жёсткость воды? Какими методами можно устранить избыточную временную жёсткость воды? Напишите необходимые уравнения химических реакций. Временная жёсткость воды равна 6,64 ммоль/л. Какую массу гидроксида кальция необходимо взять, чтобы устранить жёсткость 10 л воды.
Ответ: 2,459г.
271. Какие химические методы существуют для устранения избыточной жёсткости воды? Напишите соответствующие уравнения реакций, протекающих при умягчении воды. Сколько граммов ортофосфата натрия надо прибавить к 250 л воды, чтобы устранить ее карбонатную жёсткость, равную 2,5 ммоль/л? К какой группе жёсткости относится такая вода?
Ответ: 34,162 г.
272. Что такое титрование? На каком законе основан метод титрования? Дайте формулировку этого закона. На титрование 40 мл воды израсходовано 5,7 мл 0,12н. раствора НС1. Чему равна карбонатная жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 20 ммоль/л.
273. Чем обусловлена постоянная жёсткость воды? Какие существуют химические способы устранения постоянной жёсткости воды? Напишите уравнения соответствующих реакций. В 500 л воды содержится 70 г сульфата кальция. Чему равна постоянная жёсткость этой воды? К какой группе жёсткости относится такая вода?
Ответ: 2,1 ммоль/л.
274. Из чего складывается общая жёсткость воды? Ответ поясните. Какими методами можно устранить избыточную общую жёсткость воды? Напишите соответствующие уравнения реакций. Чему равна общая жёсткость воды, если в 300 л ее содержится 32,85 г гидрокарбоната кальция и 30,6 г сульфата магния? К какой группе жёсткости относится такая вода?
Ответ: 3,1 ммоль/л.
275. Чем обусловлена временная жёсткость воды? Какими методами можно устранить избыточную временную жёсткость воды? Напишите необходимые уравнения химических реакций. Вода, содержащая только гидрокарбонат кальция, имеет жёсткость 4,2 ммоль/л. К какой группе жёсткости относится такая вода? Сколько граммов гидрокарбоната кальция содержится в 250 л воды?
Ответ: 85,102 г.
276. Почему необходимо устранять избыточную жёсткость воды? Чем опасна такая вода? Приведите примеры. К 280 л жесткой воды прибавили 62,5 г карбоната натрия. Напишите уравнения возможных при этом реакций. Рассчитайте на сколько ммоль/л понизилась жесткость воды?
Ответ: 4 ммоль/л.
277. Чем обусловлена временная жёсткость воды? Какими методами можно устранить избыточную временную жёсткость воды? Напишите необходимые уравнения химических реакций. Вода, содержащая только гидрокарбонат магния, имеет жёсткость 7,8 ммоль/л. К какой группе жёсткости относится такая вода? Какая масса гидрокарбоната магния содержится в 350 л воды?
Ответ: 221,266 г.
278. Что понимается под жёсткостью воды? В чём измеряется жёсткость воды? Какую массу гидроксида кальция надо прибавить к 150 л воды, чтобы устранить временную жёсткость воды, равную 2,5 ммоль/л? К какой группе жёсткости относится такая вода?
Ответ: 13,89 г.
279. Что такое титрование? На каком законе основан метод титрования? Дайте формулировку этого закона. На титрование 40 мл воды потребовалось 3,85 мл 0,15 к раствора НС1. Чему равна карбонатная жёсткость воды? К какой группе жёсткости относится такая вода?
Ответ: 14,4 ммоль/л.
280. Чем обусловлена постоянная жёсткость воды? Какие существуют химические способы устранения постоянной жёсткости воды? Напишите уравнения соответствующих реакций. Чему равна жёсткость воды, в 10 л которой содержится 0,025 моль сульфата магния? К какой группе жёсткости относится такая вода?
Ответ: 5 ммоль/л.
|
из
5.00
|
Обсуждение в статье: ЖЁСТКОСТЬ ВОДЫ И МЕТОДЫ ЕЁ УСТРАНЕНИЯ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

