 |
Главная |
Аналитические реакции анионов третьей группы
|
из
5.00
|
NO2-, NO3-, CH3COO-.
Аналитические реакции нитрит-иона NO2-.
а) Реакции с солями аммония– реакция разложения (удаления) нитрит-ионов. Нитрит-ион окисляет катионы аммония 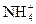 при нагревании до свободного азота
при нагревании до свободного азота  :
:
NO2-+NH4+→N2+2H2O
Аналогично до азота нитрит-ионы разрушаются и при реакции карбамидом:

Эти реакции используются для удаления нитрит-ионов из раствора.
Выполнение реакции. В пробирку вносят 5 капель раствора  , прибавляют кристаллы
, прибавляют кристаллы  или
или  до получения насыщенного раствора (часть кристаллов прибавленной соли аммония не должна раствориться) и осторожно нагревают смесь. Наблюдается выделение пузырьков газа – азота.
до получения насыщенного раствора (часть кристаллов прибавленной соли аммония не должна раствориться) и осторожно нагревают смесь. Наблюдается выделение пузырьков газа – азота.
Чтобы убедиться в полноте протекании реакции, в пробирку прибавляют каплю раствора иодида калия  и каплю крахмала. Если раствор не окрашивается в синий цвет, то это означает, что нитрит-ион в растворе отсутствует, т.е. содержащийся в растворе нитрит прореагировал с катионами аммония полностью.
и каплю крахмала. Если раствор не окрашивается в синий цвет, то это означает, что нитрит-ион в растворе отсутствует, т.е. содержащийся в растворе нитрит прореагировал с катионами аммония полностью.
б) Реакция с антипирином (фармакопейная). Нитрит-ион при взаимодействии с органическим реагентом антипирином в слабо кислой среде образует нитрозоантипирин, окрашивающий раствор в изумрудно-зеленый цвет:

Нитрит-ион NO2- с антипирином дает нитроантипирин ярко-красного цвета.
Выполнение реакции. В пробирку вносят 4-5 капель раствора  , прибавляют 4 - 5 капель раствора антипирина и каплю раствора
, прибавляют 4 - 5 капель раствора антипирина и каплю раствора  или
или  . Встряхивают пробирку. Раствор окрашивается в ярко- зеленый цвет.
. Встряхивают пробирку. Раствор окрашивается в ярко- зеленый цвет.
в) Реакция с дифениламином. В фарфоровую чашку (фарфоровый микротигель) или на чистую сухую стеклянную (фарфоровую) пластинку наносят 3-4 капли раствора дифениламина в концентрированной серной кислоте и каплю (или кристаллик) нитрита натрия NaNO2. Смесь окрашивается в ярко-синий цвет, который через некоторое время изменяется в бурый и, наконец, в желтый.
Реакция довольно чувствительна: предел обнаружения нитрат-иона составляет около 0,5 мкг.
Некоторые другие реакции нитрит-иона. Известен ряд других реакций нитрит-иона, представляющих аналитический интерес. Так с органическим реагентом этакридином в кислой среде нитрит-ион образует окрашенный в красный цвет диазоэтакридин; с солями кобальта и  в уксуснокислой среде дает желтый кристаллический осадок гексанитрокабальтата (III) калия
в уксуснокислой среде дает желтый кристаллический осадок гексанитрокабальтата (III) калия  ; с
; с  серно- или уксуснокислой среде образует комплекс состава
серно- или уксуснокислой среде образует комплекс состава 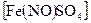 бурого цвета.
бурого цвета.
Аналитические реакции нитрат-иона  . Нитрат-ион
. Нитрат-ион  – анион одноосновной сильной азотной кислоты. В водных растворах бесцветный нитрат-ион не гидролизуется, обладает окислительными свойствами. Как лиганд нитрат-ион малоэффективен и образует неустойчивые нитратокомплексы металлов, из которых координированные нитратогруппы легко вытесняются молекулами воды в водных растворах. Поэтому в аналитической химии нитраты щелочных металлов (например,
– анион одноосновной сильной азотной кислоты. В водных растворах бесцветный нитрат-ион не гидролизуется, обладает окислительными свойствами. Как лиганд нитрат-ион малоэффективен и образует неустойчивые нитратокомплексы металлов, из которых координированные нитратогруппы легко вытесняются молекулами воды в водных растворах. Поэтому в аналитической химии нитраты щелочных металлов (например,  ) используются в качестве фона как индифферентные (т.е. не реагирующие с другими ионами в растворе) сильные электролиты для поддержания постоянной ионной силы растворе.
) используются в качестве фона как индифферентные (т.е. не реагирующие с другими ионами в растворе) сильные электролиты для поддержания постоянной ионной силы растворе.
Нитраты металлов хорошо растворяется в воде.
Некоторые аналитические реакции являются общими как для нитрат-, так и для нитрит-ионов. В отличие от нитритов, нитраты не обесцвечивают подкисленные водные растворы перманганаты калия (фармакопейный тест).
а) Реакция с дифениламином.
Выполнение реакции. В фарфоровую чашку (фарфоровый микротигель) или на чистую сухую стеклянную (фарфоровую) пластинку наносят 3-4 капли раствора дифениламина в концентрированной серной кислоте и каплю (или кристаллик) нитрата натрия NaNO3. Смесь окрашивается в ярко-синий цвет, который через некоторое время изменяется в бурый и, наконец, в желтый.
Реакция довольно чувствительна: предел обнаружения нитрат-иона составляет около 0,5 мкг.
б) Реакция с металлической медью (фармакопейная).Нитрат-ион взаимодействует в среде концентрированной серной кислоты при нагревании с металлической медью с образованием буро-желтых паров оксидов азота:
2NO3-+8H++3Cu→3Cu2++2NO↑+4H2O
2NO+O2→2NO2↑
Выполнение реакции. В пробирку вносят 2-3 капли раствора нитрата калия, прибавляют 3-4 капли концентрированной серной кислоты, кусочек металлической меди и осторожно нагревают пробирку (под тягой!). Выделяются буро-желтые пары диоксида азота.
в) Реакция с сульфатом железа (II) и концентрированной серной кислотой.Нитрат-ион при нагревании с  в среде концентрированной
в среде концентрированной  образует соединение состава
образует соединение состава  , окрашенное в бурый цвет:
, окрашенное в бурый цвет:
3Fe2++NO3-+4H+→3Fe3++NO↑+2H2O
Fe2++ NO+SO42-→[FeNO]SO4
Реакцию с образованием того же соединения дает и нитрит-ион, поэтому нельзя открыть этой реакцией нитрат-ион в присутствии нитрит-иона.
Предел обнаружения нитрат-ионов – около 2,5 мкг.
Мешают анионы 
Выполнение реакции. а) В пробирку вносят 4 - 6 капель  или
или  , 6-8 капель насыщенного раствора
, 6-8 капель насыщенного раствора  и осторожно по стенке пробирки приливают по каплям концентрированную серную кислоту. При соприкосновении раствора
и осторожно по стенке пробирки приливают по каплям концентрированную серную кислоту. При соприкосновении раствора  с раствором в пробирке появляется бурое окрашивание жидкости.
с раствором в пробирке появляется бурое окрашивание жидкости.
б) На поверхность стеклянной пластинки наносят каплю раствора  или
или  , к которой прибавляют кристаллик сульфата железа и каплю концентрированной серной кислоты. Около кристалла образуется бурое пятно.
, к которой прибавляют кристаллик сульфата железа и каплю концентрированной серной кислоты. Около кристалла образуется бурое пятно.
г) Реакция с антипирином.Нитрат-ион образует с антипирином в кислой среде нитроантипирин ярко-красного цвета:

Выполнение реакции.В пробирку вносят 2-3 капли раствора  или
или  , 2-3 капли антипирина и осторожно, по каплям прибавляют 12-15 капель концентрированной серной кислоты при встряхивании пробирки до появления ярко-красной окраски нитроантипирина.
, 2-3 капли антипирина и осторожно, по каплям прибавляют 12-15 капель концентрированной серной кислоты при встряхивании пробирки до появления ярко-красной окраски нитроантипирина.
д) Реакция с металлическим алюминием или цинком.Нитрат – ион при взаимодействии с металлическим алюминием или цинком в щелочной среде восстанавливается до аммиака:
3NO3-+8Al+5OH-+18H2O→3NH3↑+[8Al(OH)4]-
Выделяющийся аммиак ощущается по запаху и окрашивает влажную красную лакмусовую бумажку в синий цвет.
Мешают катионы аммония 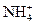 , выделяющие аммиак в щелочной среде, а также другие анионы, способные восстанавливаться до аммиака (
, выделяющие аммиак в щелочной среде, а также другие анионы, способные восстанавливаться до аммиака (  ферро- и феррицианид - ионы).
ферро- и феррицианид - ионы).
Выполнение реакции.В пробирку вносят 5-6 капель раствора  или
или  , 5-6 капель раствора
, 5-6 капель раствора  и несколько кусочков металлического алюминия. Смесь осторожно нагревают. Ощущается запах аммиака. Над пробиркой помещают влажную лакмусовою бумагу - бумага синеет.
и несколько кусочков металлического алюминия. Смесь осторожно нагревают. Ощущается запах аммиака. Над пробиркой помещают влажную лакмусовою бумагу - бумага синеет.
Другие реакции нитрат – ионов. Известно сравнительно небольшое число аналитических реакций, позволяющих при определенных условиях открывать нитрат-ион в растворе. К ним можно отнести восстановление нитрат – иона до нитрит – иона металлическим цинком в уксусной среде, реакцию с органическим – нитроном 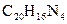 в уксусной среде (образуется белые игольчатые кристаллы нитрата нитрона
в уксусной среде (образуется белые игольчатые кристаллы нитрата нитрона  ) и некоторые другие.
) и некоторые другие.
Аналитические реакции ацетат-иона CH3COO-.
Ацетат-ион  – анион слабой (рК=4,76) одноосновной уксусной кислоты CH3COOН; в водных растворах бесцветен, подвергается гидролизу, не обладает окислительно-восстановительными свойствами. При реакциях со спиртами в кислой среде дает сложные эфиры.
– анион слабой (рК=4,76) одноосновной уксусной кислоты CH3COOН; в водных растворах бесцветен, подвергается гидролизу, не обладает окислительно-восстановительными свойствами. При реакциях со спиртами в кислой среде дает сложные эфиры.
Ацетат-ион – довольно эффективный лиганд и образует устойчивые ацетатные комплексы с катионами многих металлов.
Ацетаты аммония, щелочных и большинства других металлов хорошо растворяются в воде.
а) Реакция с хлоридом железа(III) (фармакопейная): Ацетат-ион с катионами железа (III) при рН=5-8 дает растворимый темно-красный (цвета крепкого чая) ацетат или оксиацетат железа (III).
В водном растворе он частично гидролизуется; подкисление раствора минеральными кислотами подавляет гидролиз и приводит к исчезновению красной окраски.
При кипячении первоначально полученного раствора из него выпадает хлопьевидный осадок основного ацетата железа (III) Fe(OH)2CH3COO, образующегося за счет глубокого протекания гидролиза:

Осадок выделяется только при избытке ацетат-ионов в растворе.
В зависимости от соотношения концентраций железа (III) и ацетат-ионов состав осадка может изменяться и отвечать, например, формулам FeOH (CH3COO) 2 , Fe3 (OH)2 О3(CH3COO) ,
Fe3 О (OH)(CH3COO)6 или Fe3 (OH)2 (CH3COO)7 .
Мешают ионы 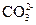 ,
,  ,
,  ,
,  образующие осадки с железом (III), а также ионы SCN- (дающие красные комплексы с катионами железа Fe3+), иодид-ион I- , окисляющийся до I2 , придающего раствору желтую окраску.
образующие осадки с железом (III), а также ионы SCN- (дающие красные комплексы с катионами железа Fe3+), иодид-ион I- , окисляющийся до I2 , придающего раствору желтую окраску.
Выполнение реакции..В пробирку вносят 6-7 капель раствора ацетата натрия  и прибавляют 2-3 капли раствора хлорида железа (III) FeCl3 . Раствор окрашивается в красно-бурый цвет. Осторожно нагревают содержимое пробирки до кипения и кипятят раствор. При кипении из раствора выпадает красно-бурый осадок основного ацетата железа (III).
и прибавляют 2-3 капли раствора хлорида железа (III) FeCl3 . Раствор окрашивается в красно-бурый цвет. Осторожно нагревают содержимое пробирки до кипения и кипятят раствор. При кипении из раствора выпадает красно-бурый осадок основного ацетата железа (III).
б) Реакция образования уксусноэтилового эфира (фармакопейная). Ацетат-ион в серно кислой среде (концентрированная серная кислота) реагирует со сложными спиртами с образованием сложных эфиров уксусной кислоты. Так, при взаимодействии с эталоном образуется уксусноэтиловый эфир (этилацетат) 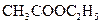 :
:
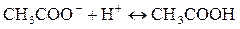

Выделяющийся этилацетат обнаруживают по характерному приятному запаху.
Соли серебра катализируют эту реакцию, поэтому при ее проведении рекомендуется добавлять небольшое количество  .
.
Аналогично при реакции с амиловым спиртом  образуется также обладающим приятным запахом амилацетат
образуется также обладающим приятным запахом амилацетат  (так называемая «грушевая эссенция»).
(так называемая «грушевая эссенция»).
Выполнение реакции. а) В пробирку вносят небольшое количество ацетата натрия  , прибавляют 4-5 капель концентрированной серной кислотой , 4-5 капель этилового спирта, 1-2 капли раствора
, прибавляют 4-5 капель концентрированной серной кислотой , 4-5 капель этилового спирта, 1-2 капли раствора  (катализатор) и осторожно нагревают смесь. Ощущается характерный приятный запах уксусноэтилового эфира.
(катализатор) и осторожно нагревают смесь. Ощущается характерный приятный запах уксусноэтилового эфира.
б) В пробирку вносят 4-5 капель концентрированного раствора ацетата натрия, столько же капель концентрированной серной кислоты, 1-2 капли раствора  (катализатор) и 4-5 капель эталона. Ощущается характерный запах этилацетата, усиливающийся при осторожном нагревании смеси.
(катализатор) и 4-5 капель эталона. Ощущается характерный запах этилацетата, усиливающийся при осторожном нагревании смеси.
в) Реакция с серной кислотой. Ацетат-ион в сильной кислой среде переходит в слабую уксусную кислоту, пары которой характерный запах уксуса:

Мешают анионы  также выделяющиеся в среде концентрированный серной кислоты газообразные продукты с характерным запахом.
также выделяющиеся в среде концентрированный серной кислоты газообразные продукты с характерным запахом.
Некоторые другие реакции ацетата-иона. Ацетат-ионы при реакции с нитратом лантана  и раствором иода в аммиачной среде образуют продукты реакции синего или синевато-бурого цвета. Мешают
и раствором иода в аммиачной среде образуют продукты реакции синего или синевато-бурого цвета. Мешают 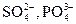 .
.
При растирании твердых проб, содержащих ацетаты с твердыми NaHSO4 или KHSO4 выделяется уксусная кислота CH3COOН, обнаруживаемая по характерному запаху уксуса.
V. Литература.
1. Ю.Я. Харитонов. Аналитическая химия. Высшая школа, М., 2001 г, гл. 7, с. 179-199, с.211-215.
2. В.П. Васильев. Аналитическая химия. Книга 1. Титриметрические и гравиметрический методы анализа. Высшее образование. М., 2004 г. С. 166-184.
3. Ю.Я. Золотов. Основы аналитической химии. Практическое руководство. Высшая школа, М., 2001 г., с. 87 - 95.
4. Лекции.
З А Н Я Т И Е № 8
I.Тема: УИРС: анализ смеси анионов.
II.Цель: 1. Научиться производить расчеты условий образования осадков в растворах с участием комплексных соединений, термодинамических констант устойчивости β и нестойкости Кн комплексных соединений.
2. Научиться определять в пробах анионы III группы.
|
из
5.00
|
Обсуждение в статье: Аналитические реакции анионов третьей группы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

