 |
Главная |
СТАНДАРТИЗАЦИЯ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ
|
из
5.00
|
Внедрение в отечественную медицинскую практику новых видов лекарственного растительного сырья, продуктов его переработки, расширение ассортимента фитопрепаратов, требует совершенствования системы стандартизации и контроля их качества.
Лекарственные средства, в том числе лекарственное растительное сырье, применяемое в медицинской практике, должны отвечать всем современным требованиям безопасности для человека и быть эффективными для лечения различных заболеваний.
В официальной медицине России разрешено применять только те лекарственные средства, которые зарегистрированы в Государственном Реестре лекарственных средств Российской Федерации и имеют сертификат соответствия.
На каждом этапе создания, изготовления и обращения лекарственных средств, принимаются специфическиедля данного этапамеры, позволяющие не допустить ошибки и отклонения в работе, способные отрицательно повлиять на качество препарата.
С 1990 года в Российской Федерации проводится работа по приближению отечественных стандартов качества, имеющих национальные различия, к стандартам, принятым в международной практике.
Как показал мировой опыт, намного эффективнее обеспечить контроль качества на всех стадиях разработки препарата, чем проводить его уже после того, как препарат создан.
Это позволяет унифицировать стандарты, приводит к снижению стоимости и времени разработки новых лекарственных средств, что выгодно всем, но в первую очередь, пациентам.
Таким образом, цепочка обеспечения качества должна охватывать весь цикл создания лекарственного средства от сырья до фитопрепарата.
*****
В 1998 году Министерство здравоохранения РФ приняло в качестве отраслевого стандарта - стандарт
GСР - правила надлежащей клинической практики,позволяющей объективно оценить эффективность лекарственных средств.
Ведется разработка стандарта
GLР - правила надлежащей лабораторной практики, обеспечивающей безопасность препаратов.
К 2005 году МЗ РФ обязал российских производителей перейти на стандарт
GMР- правила надлежащей производственной практики, позволяющий обеспечить соблюдение всех аспектов качества при производстве лекарственных средств.
В феврале 1998 года был утвержден ОСТ 42-0510-98 «Правила организации производства и контроля качества лекарственных средств»,
включающий меры по повышению качества с акцентом на международную гармонизацию норм, правил, стандартов для внедрения правил GМР.
Для сырья и фитопрепаратов выше изложенное иллюстрируется таблицей, в которой ячейки соответствуют этапам производства, подлежащим выполнению с соблюдением правил GМР.
Таблица
.
| Тип производства | Применимость руководства к стадиям производства | ||||
| Извлечение из растительного материала | Сбор растений | Резка и первичное извлечение | Введение исходных материалов в процесс | Выделение и очистка | Физическая обработка и упаковка |
| Субстанции, полученные из сырья животного происхождения | Сбор органов, жидкостей или тканей | Измельчение, смешивание и\или первичная обработка | Введение исходных материалов в процесс | Выделение и очистка | Физическая обработка и упаковка |
| Биотехнология Ферментация Клеточные культуры | Создание основного и рабочего банка клеток | Поддержание рабочего банка клеток | Клеточная культура или ферментация | Выделение и очистка | Физическая обработка и упаковка |
| Классическая ферментация | Создание банка клеток | Поддержание банка клеток | Введение клеток в ферментацию | Выделение и очистка | Физическая обработка и упаковка |
| Резанные или измельченные части растений | Сбор растений и\или культивация и сбор урожая | Резка, измельчение | Физическая обработка и упаковка | ||
| Растительные экстракты | Сбор растений | Резка и первичное извлечение | Последующая экстракция | Физическая обработка и упаковка |
Федеральный закон «О лекарственных средствах», принятый в 1998 году установил приоритет государственного контроля над регистрацией, качеством и безопасностью лекарственных средств.
Государственный контроль Советом Министров РФ возложен на Министерство здравоохранения РФ, которому поручено создать единую контрольно-разрешительную систему: экспертизы, стандартизации, регистрации и контроля качества лекарственных средств.
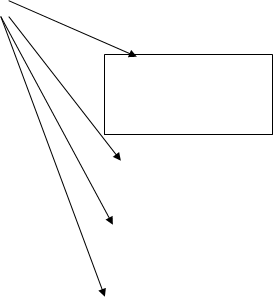
Министерством здравоохранения РФ создана структура, которая объединяет все звенья контрольно-разрешительной системы и обеспечивает их взаимодействие.
 Совет Министров
Совет Министров
 |  | ||
 Госстандарт РФ
Госстандарт РФ
 Министерство здравоохранения РФ
Министерство здравоохранения РФ
 |
Департамент Гос.контроля качества,
эффективности и безопасности лекарст-
венных средств и медицинской техники
 |  |  |  | ||||




Фармакологиче- Фармакопейный Федеральная инспек- Отдел лицензий
ческий Комитет РФ ция и Отдел экспер-
тизы ЛС
Комитет РФ
 | |||
 | |||
 Государственный Институт клиниче- Государственный НИИ
Государственный Институт клиниче- Государственный НИИ
 научный центр ской фармакологии по стандартизации и
научный центр ской фармакологии по стандартизации и
 экспертизы и контролю качества
экспертизы и контролю качества
 контроля каче- ЛС
контроля каче- ЛС
ства ЛС Институт доклиниче-


 ской экспертизы
ской экспертизы
 |
 НПО ВИЛАР
НПО ВИЛАР
Институт стандарти-
зации


 НИИ
НИИ
Институт конт- Инспекция обращения
 Роля качества ЛС
Роля качества ЛС
ЛС ВУЗы
**
Основным звеном в этой системе является Департамент государственного контроля качества, эффективности и безопасности лекарственных средств и медицинской техники.
В его задачи входит:
- прием заявок на разработку новых препаратов;
- издание Государственного Реестра лекарственных средств;
- издание документов по контролю качества лекарственных средств;
- координирование работы подчиненных структур по реализации качества и т.д.
Под руководством Департамента работают два комитета - фармакологический и фармакопейный.
Фармакологический комитет проводит экспертизу на эффективность и безопасность лекарственных средств.
Экспертиза осуществляется в Государственном научном центре экспертизы и контроля качества лекарственных средств МЗ на его клинических базах, к которым относят:
институт клинической фармакологии,
институт доклинической экспертизы,
институт стандартизации и другие медицинские учреждения,
имеющие право на проведение клинических испытаний.
Государственный научный центр экспертизы и контроля качества ЛС создан в феврале 1999 года.
В его функции входит:
организация экспертизы документации на новые препараты;
научная экспертиза препаратов;
исследования побочных действий лекарств;
подготовка экспертных заключений и т.д.
Фармакологический комитет принимает решение о допуске и регистрации лекарственных растительных средств и введении их в Государственный Реестр лекарственных средств РФ.
В Государственный Реестр лекарственных средств включено около 300 видов лекарственного растительного сырья.
Для каждого вида сырья в Государственном Реестре приводится:
- название;
- фармакологическое действие;
- форма выпуска;
- № государственной регистрации;
- год регистрации или перерегистрации.
Задачами Фармакопейного комитета являются экспертиза и подготовка нормативной документации, в том числе Государственной Фармакопеи.
Эта деятельность осуществляется при участии Государственного научно-исследовательского института по стандартизации и контролю качества лекарственных средств,
Научно-исследовательского института лекарственных растений, профильных ВУЗов.
В составе Фармакопейного комитета работает 12 экспертных комиссий, в том числе Комиссия по лекарственному растительному сырью и фитопрепаратам.
Федеральная инспекция производства лекарственных средств с отделом экспертизы принимает решение
о выдаче лицензий на производство и изготовление ЛС;
осуществляет контроль производства ЛС и качества выпускаемой продукции;
контроль качества импортируемых ЛС и т.д.
Отдел лицензий и разрешений выдает: лицензии на производство ЛС в соответствии с решением Федеральной инспекции производства ЛС;
лицензии на торговую деятельность предприятий и т.д.
Основные понятия и определения
Все рассмотренные подразделения должны обеспечивать научное и методическое руководство по организации стандартизации и контролю качества лекарственных средств.
Основным гарантом качества лекарственных средств, в том числе растительного сырья, является их стандартизация, которая позволяет, также, обеспечить ресурсосберегающую технологию производства фитопрепаратов.
Стандартизация - государственная система единых норм и требований к качеству лекарственного растительного сырья и методам его испытаний,тоесть это процесс разработки стандарта.
Для лекарственного растительного сырья - это разработка, например, Фармакопейной статьи.
Стандарт - нормативный документ, регламентирующий нормы и показатели качества, или методы его испытания.
Качество и безопасность лекарственных средств устанавливается их сертификацией.
С 01.12.1998 года в Российской Федерации введена единая система сертификации лекарственных средств.
Сертификация - процесс определения соответствия качества - требованиям стандарта.
Для лекарственного растительного сырья - это соответствие требованиям, например, Фармакопейной статьи по результатам товароведческого анализа.
Сертификат соответствия — документ, удостоверяющий качество лекарственного растительного сырья.
Он выдается на основании протокола товароведческого анализа органами по сертификации, сроком на 1 год.
Качество - совокупность свойств лекарственного растительного сырья, которое выражаются в нормах и показателях, и строго регламентируется государством в нормативных документах, то есть, стандартах.
По степени качества лекарственное растительное сырье имеет 2 градации:
доброкачественное и недоброкачественное (абсолютно недоброкачественное или с дефектами, которые устраняются доведением сырья до стандартного состояния).
****
Стандартизация лекарственного растительного сырья - задача комплексная, предусматривающая особые условия и свойства, которые:
1) предопределяют
2) обеспечивают
3) поддерживают качество лекарственного растительного сырья.
1 ступень.
Условия, предопределяющие качество лекарственного растительного сырья.
Их выполнение обязательно в процессе заготовки сырья.
Для обеспечения высокого качества сырья необходимо правильно выбрать район и место заготовки,
а для культивируемых видов - район культуры.
Регламентируются
сроки и приемы сбора,
характер первичной обработки сырья,
условия сушки,
сортировки и упаковка.
Эти условия описаны в единых для всех заготовителей «Инструкциях по сбору и сушке» на каждый вид сырья. Они имеют силу закона. В действующий сборник включены инструкции на 121 вид лекарственного сырья.
Ступень.
Условия, обеспечивающие качество лекарственного растительного сырья.
Это нормы, обеспечивающие
определение подлинности,
чистоты и доброкачественности сырья.
Они регламентируются стандартом и определяются при проведении полного товароведческого анализа конкретного вида сырья.
Ступень.
Условия, регламентирующее поддержание и сохранение качества сырья.
Нормируются
условия хранения сырья (температурный режим, влажность, срок и, для некоторых видов сырья, список хранения) а также,
требования к упаковке,
условия транспортирования.
Таким образом, обязательные нормы и требования к качеству сырья изложены в разнообразных стандартах, обобщенно называемых«Нормативная документация (НД)».
НД существуют на каждый вид сырья и его товарную форму: (цельное, резаное, брикетированное и т.д.),
а также субстанции и лекарственные формы.
НД имеет статус закона. Несоблюдение ее требований преследуется по закону.
**
|
из
5.00
|
Обсуждение в статье: СТАНДАРТИЗАЦИЯ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

