 |
Главная |
Пример расчета газового цикла
|
из
5.00
|
Дано: цикл, отнесенный к 1 кг воздуха в координатах p-v и состоящий из четырех процессов: адиабатного 1-2, изохорного 2-3, политропного 3-4, изобарного 4-1; некоторые параметры точек цикла (рис. 1.9.)
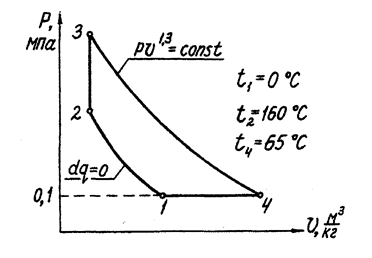 |
Рис. 1.9. Газовый цикл в p-v – координатах.
1.Определение параметров p, T, v, u, h для основных точек цикла
а). Для точки 1 дано: p1 = 0,1 MΠa, t1 = 0°C.
Определим v1, u1, h1.
Удельный объем
v1 =  м³/кг.
м³/кг.
Условно принимаем, что внутренняя энергия и энтальпия равны нулю при t = 0°C, тогда
u1 = Cv · t1 = 0,
h1 = Cp · t1 = 0.
б). Для точки 2 дано: t2 = 160°C. Определим v2, p2, u2, h2.
Для нахождения v2 используем уравнение адиабаты в v,T координатах
T · v 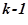 = const,
= const,
где
k = 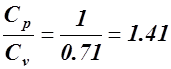 ,
,
или
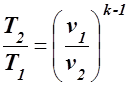 ,
,
откуда
v2 = v1 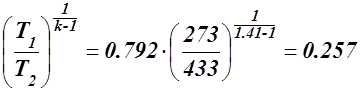 м³/кг.
м³/кг.
Для определения давления p2 используем уравнение состояния p2 v2 = RT2, откуда
p2 = 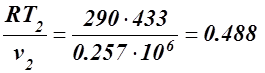 МПа.
МПа.
Внутренняя энергия u2 = Cv · t2 = 0.71 · 160 = 114 кДж/кг,
энтальпия h2 = Cp· t2 = 1.0 · 160 = 160 кДж/кг.
в). Для точки 4 дано: t4 = 65°C; p4 = p1 = 0.1 MΠa.
Определим v4, u4, h4.
Для определения v4 используем соотношение параметров изобарного процесса 4 – 1
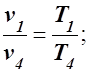 v4 =
v4 = 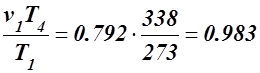 м³/кг.
м³/кг.
Внутренняя энергия u4 = Cv · t4 = 0.71 · 65 = 46.15 кДж/кг,
энтальпия h4 = Cp · t4 = 1.0 · 65 = 65 кДж/кг.
г). Для точки 3 дано: v3 = v2 = 0.257 м³/кг.
Определим T3 , p3 , u3 , h3 .
Для нахождения T3 используем уравнение политропы
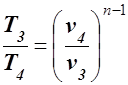 ,
,
T3 = T4 · 


Для определения p3 используем уравнение состояния
p3 = 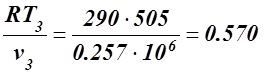 МПа.
МПа.
Внутренняя энергия u3 = Cv · t3 = 0.71 · 233 = 165.43 кДж/кг,
энтальпия h3 = Cp · t3 = 1.0 · 233 = 233 кДж/кг.
Таблица 1.2.
| Параметры Точки | р, МПа | v, м³/кг | Т, К | и, кДж/кг | h, кДж/кг |
| 0,100 | 0,792 | ||||
| 0,488 | 0,257 | ||||
| 0,570 | 0,257 | 165,43 | |||
| 0,100 | 0,981 | 46,15 |
Результаты расчетов помещаем в табл. 1.2.
2. Для каждого процесса, входящего в состав цикла, найдем n, c, Δu, Δh, Δs, q, l, a, b.
Определим перечисленные величины
а). Для адиабатного процесса 1 – 2 при Cp = const, Cv = const
n = k = 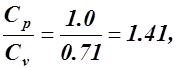
с = 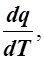 так как для адиабаты dq = 0, то c = 0.
так как для адиабаты dq = 0, то c = 0.

Изменение внутренней энергии Δu1-2 = u2 - u1 = 144 – 0 = 144 кДж/кг.
Изменение энтальпии Δh1-2 = h2 - h1 = 160 – 0 = 160 кДж/кг.
Изменение энтропии Δs1-2 = s2 - s1 = 0, так как для обратимой адиабаты
s = const. Адиабатный процесс протекает без теплообмена с окружающей средой, поэтому q = 0.
Работу процесса определим из уравнения первого закона термодинамики q=Δu +l, т.к. q = 0, тоl = - Δu = - 114 кДж/кг. Величины a,b не определяем, т.к. теплота процесса q = 0.
б). Для изохорного процесса 2 – 3 показатель политропы n = ±∞, теплоемкость Cv = 0.71 кДж/кг·К. Изменение внутренней энергии
Δu2-3 = u3 - u2 = 165.43 – 114 = 51.43 кДж/кг.
Изменение энтальпии и энтропии
Δh2-3 = h3 - h2 = 233 – 160 = 73 кДж/кг;
Δs2-3 = s3 - s2 = Cv ln 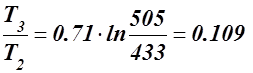 кДж/кг·К.
кДж/кг·К.
Для изохорного процесса l = 0, поэтому для этого процесса из уравнения первого закона термодинамики следует
q = Δu = u3 - u2 = 51.43 кДж/кг.
a = 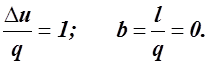
в). Для политропного процесса 3 – 4 при показателе политропы n = 1.3
C = Cv 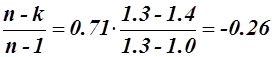 кДж/кг·К;
кДж/кг·К;
Δu3-4 = u4 - u3 = 46.15 - 165.43 = - 119.28 кДж/кг;
Δh3-4 = h4 - h3 = 65 – 233 = - 168 кДж/кг;
Δs3-4 = s4 - s3 = Cv ln 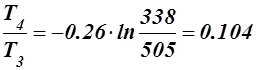 кДж/кг·К;
кДж/кг·К;
q = c(T4 - T3) = - 0.26(338 - 505) = 43.42 кДж/кг.
|
из
5.00
|
Обсуждение в статье: Пример расчета газового цикла |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

