 |
Главная |
Кислотные свойства гидроксисоединений
|
из
5.00
|
Одноатомные спирты реагируют с активными металлами (Na, K, Mg, Al и др), образуя соли - алкоголяты (алкоксиды):
2R–OH + 2Na 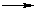 2RO–Na+ + H2
2RO–Na+ + H2
2C2H5OH + 2K 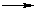 2C2H5O–K+ + H2
2C2H5O–K+ + H2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла:
C2H5OК + H2O 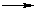 C2H5OH + КOH
C2H5OH + КOH
Спирты – более слабые кислоты, чем вода, т.к. алкильный радикал, проявляя +I-эффект, повышает электронную плотность на атоме кислорода и уменьшает полярность связи О–Н. Поэтому при взаимодействии спиртов со щелочами алкоголяты практически не образуются:
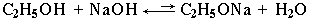
(равновесие этой реакции сдвинуто влево,
т.к. соли спиртов в воде гидролизуются)
Кислотность одноатомных спиртов убывает в ряду:
CH3OH > первичный > вторичный > третичный
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов:
2HO–CH2CH2–OH + 4Na  2NaO–СH2CH2–ONa + 2H2
2NaO–СH2CH2–ONa + 2H2
HO–CH2CH2–OH + 2NaOH  NaO–CH2CH2–ONa + 2H2O
NaO–CH2CH2–ONa + 2H2O
Такие спирты, в отличие от одноатомных, взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соединения, окрашивающие раствор в ярко-синий цвет (качественная реакция):

Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы реагируют не только с металлическим натрием, но и с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты:
C6H5OH + NaOH  C6H5ONa + H2O
C6H5ONa + H2O
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Образование сложных эфиров
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).



Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
Фенолы не образуют сложные эфиры в реакциях с кислотами. Для этого используются более реакционноспособные производные кислот (ангидриды, хлорангидриды).

Окисление
Окислители – KMnO4, K2Cr2O7+H2SO4, CuO, O2+катализатор. Легкость окисления спиртов уменьшается в ряду:
первичные ≥ вторичные >> третичные.
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.

При окислении вторичных спиртов образуются кетоны.

Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Процесс идет через стадию дегидратации спирта с последующим деструктивным (жестким) окислением алкена. Например:
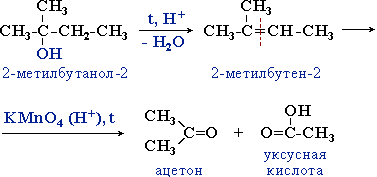
Предельное окисление гидроксисоединений до CO2 и Н2О происходит при их горении, например:
2CH3OH + 3O2  2CO2 + 4H2O
2CO2 + 4H2O
Полное окисление метанола идет схеме:

При сгорании спиртов выделяется большое количество тепла.
C2H5OH + 3O2  2CO2 + 3H2O + 1370 кДж
2CO2 + 3H2O + 1370 кДж
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В лабораторной практике этанол применяется как горючее для "спиртовок".
Реакции по связи С–О
Наиболее характерные реакции гидроксисоединений, происходящие с разрывом связи С–О:
· реакция замещения OH-группы на галоген или другую нуклеофильную группу (RO–, NH2– и т.п.), идущая по механизму нуклеофильного замещения SN;
· реакция отщепления (элиминирования) ОН и Н от соседних атомов углерода (внутримолекулярная дегидратация спиртов – образование алкенов);
· реакция замещения группы ОН при разрыве связи С–О в одной молекуле и замещения атома Н с разрывом связи О–Н – в другой молекуле гидроксисоединения (межмолекулярная дегидратация – образование простых эфиров).
Реакционная способность спиртов в реакциях по связи С–О:
третичные > вторичные > первичные > CH3OH
Для фенолов реакции этого типа не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
|
из
5.00
|
Обсуждение в статье: Кислотные свойства гидроксисоединений |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

