 |
Главная |
Радикальная полимеризация
|
из
5.00
|
Радикальная полимеризация – один из наиболее распространенных методов синтеза полимеров. При радикальной полимеризации активным центром является свободный радикал.
Способность мономеров к полимеризации обусловлена термодинамическими и кинетическими факторами. Термодинамические факторы определяются количеством свободной энергии и энтропией, кинетические – природой мономеров и активных центров и условиями процесса. Термодинамически возможна полимеризация любого мономера с двойной связью, а кинетически эта реакция не всегда возможна. Например, этилен имеет наибольшую теплоту полимеризации, однако он полимеризуется только в присутствии катализатора Циглера –Натта.
Способность мономеров к радикальной полимеризации зависит от его природы, от природы заместителя при двойной связи. Влияние заместителей определяется электронными (сопряжение и индуктивный эффект) и стерическими эффектами.
Эффект сопряжения приводит к поляризации двойной связи, к е ослаблению, а следовательно к повышению реакционной способности мономера
Заместители – доноры электронов (алкильная, алкоксигруппа), увеличивая электронную плотность на атоме углерода метиленовой группы, вызывают положительный индуктивный эффект.
s- s+
CH2=CH R - алкил, алкоксигруппа
Заместители – акцепторы электронов способствуют повышению электронной плотности у того атома углерода, с которым связан заместитель, например:
s+ s-
СН2=СН ® Х - нитрогруппа, галоген, карбонильная группа
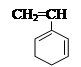
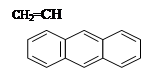 Наличие в молекуле мономера одного объемистого или нескольких заместителей вызывает экранирование двойной связи. Подобные стерические эффекты снижают реакционную способность мономера. Например, винилантрацен менее реакционноспособен, чем стирол.
Наличие в молекуле мономера одного объемистого или нескольких заместителей вызывает экранирование двойной связи. Подобные стерические эффекты снижают реакционную способность мономера. Например, винилантрацен менее реакционноспособен, чем стирол.
 | |||
 | |||
винилантрацен стирол
Симметричное расположение заместителей также вызывает стерический эффект. Так, 1,2 – дихлорэтилен за счет экранирования заместителями двойной связи не полимеризуется, тогда как 1,1 – дихлорэтилен, где двойная связь сильно поляризована, полимеризуется легко.
ClCH=CHCl СН2=CCl2
1,2 дихлорэтилен 1,1 дихлорэтилен
Основными стадиями радикальной полимеризации являются: инициирование, рост цепи, обрыв цепи и передача цепи.
1. Инициирование – это процесс образования свободнорадикальных центров R*. Благодаря наличию неспаренных электронов они легко вступают в реакцию с мономерами, превращая его в свободный радикал.

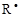 +
+
 | |||
 | |||
Свободные радикалы можно получить различными методами. При термическом инициировании – тепловым воздействием, при фотоинициировании – под действием света, при радиационном инициировании – под действием радиоактивного облучения, при химическом инициировании – в присутствии специально добавленных веществ инициаторов. На практике чаще применяют метод химического инициирования. Вещества, называемые инициаторами, под действием тепла, световой или других видов энергии подвергаются гомолитическому распаду. В качестве инициаторов применяются пероксиды, гидропероксиды, азо – и диазосоединения, окислительно – восстановительные системы.
Пероксиды и гидропероксиды распадаются по связи О – О, обладающей наименьшей по сравнению с остальными связями энергией. Пероксид бензоила, например, разлагается с образованием двух бензоатных радикалов, которые вновь распадаются с образованием фенильного радикала и СО2.
O O O
|| || 80-950C ||
С6Н5 – С – О – О – С - С6Н5 ® 2 C6H5 – C – O*® 2 C6H5*+CO2
пероксид бензоила бензоатный фенильный
радикал радикал
Гидроперикиси распадаются с образованием двух свободных радикалов – R* и ОН*.
R¢¢ R¢¢
| |
R¢ - C – O – OH ® R¢ - C = O + R* + OH*
|
R
Из азосоединений в качестве инициатора применяют динитрил азоизомасляной кислоты (азобисизобутиронитрил), распадающийся по связям C – N на два радикала с выделением азота:
CH3 CH3 CH3
| | 50-700C |
NºC – C – N=N – C - CºN ® 2 NºC – C* + N2
| | |
CH3 CH3 CH3
Диазоаминобензол распадается в две стадии с образованием двух различных радикалов и азота:
C6H5 – NH – N=N – C6H5 ® C6H5 – N*H + N*=N – C6H5_
¯
C6H5*+ N2
Персульфат калия распадается по следующей схеме:
O O O O
|| || ---- || || ---_ 40-600C
K – O – S –O - O – S – O – K ® 2K+ + O – S – O – O –S – O ®
|| || || ||
O O O O
O
--- ||
® 2 O – S – O* ® 2HSO-4 + 2HO*
||
O
Выбор инициатора чаще всего обусловлен его растворимостью в мономере или растворителе и температурой, при которой может быть достигнута определенная скорость получения свободных радикалов. Для облегчения распада инициаторов применяют окислительно – восстановительные системы. В качестве примера можно взять реакцию между пероксидом водорода и солью двухвалентного железа.
H2O2 + Fe2+ ® HO- + HO* + Fe3+
Fe2+ + HO* ® Fe3+ + HO-
HO* + H2O2 ® HOO* + H2O
Fe3+ + HOO* ® Fe2+ + O2 + H+
Процесс инициирования характеризуется двумя последовательными реакциями: разложение инициатора Jn с образованием свободных радикалов R* и взаимодействие радикала R* с мономером М с образованием активного центра свободнорадикального типа RM*:
kин k’ин
Jn ® 2R*, R* + M ® RM*
где kин и k’ин – константы скоростей соответствующих реакций.
В большинстве случаев kин < k’ин, поэтому скорость процесса описывается формулой
Vин = kин [In], (1)
где [Jn] – концентрация инициатора.
1.Рост цепи заключается в последовательном присоединении молекул мономера к образующемуся активному центру с передачей его на конец цепи.
kp
RM* + M ® RMM*
kp
RMM* + M ® RMMM*
………………………..
kp
R – [M]n-2 – M* + M ® R – [M]n-1 – M*
Если предположить, что активность растущего полимерного радикала не зависит от длины цепи, то скорость реакции роста цепи Vp описывается уравнением
Vp = kp[M*][M] (2 )
где [M*] и [M] – концентрации радикала и мономера.
1.Обрыв в цепи происходит в результате гибели активных центров. При этом происходит обрыв и материальной, и кинетической цепи. Обрыв цепи может протекать в результате взаимодействия двух растущих радикалов путем их рекомбинации или диспропорционирования.
Скорость обрыва цепи V0 выражают уравнением
V0 = k0 [M*]2 ( 3 )
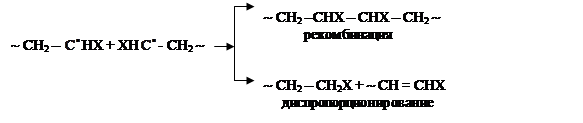
Обрыв цепи идет в основном при начальных этапах, когда вязкость системы невелика. При увеличении вязкости системы скорость обрыва цепи уменьшается. При достижении определенной степени конверсии увеличение вязкости приводит к ускорению полимеризации. Это явление получило название гель – эффект.
4. Передача цепи происходит путем отрыва растущим радикалом атома или группы атомов от какой – либо молекулы (передатчика цепи). При этом растущий радикал превращается в валентно – насыщенную молекулу, а возникающий новый радикал развивает кинетическую цепь. Передача цепи может осуществляться через молекулу, например винилацетат
kM
~ M* + CH2 = CH – OCOCH3 ® ~ HM + CH2 = CH – OCOC*H2
через молекулу растворителя, например толуола
kS
~ M* + C6H5CH3 ® ~ MH + C6H5C*H2
или через специально вводимые вещества (регуляторы), например меркоптаны (RSH), ароматические амины (RNH2), нитросоединения (RNO2) и т.д.
Если эти вещества полностью обрывают цепь, и останавливают полимеризацию, их называют ингибиторами. Если в их присутствии реакция только замедляется, то они называются замедлителями.
Увеличение количества агента передачи цепи (например, галогенсодержащих углеводородов) – приводит к резкому возрастанию скорости реакции передачи цепи, и промежуточные низкомолекулярные соединения можно разделить (реакция теломеризации):
2СН2 = СН2 + СCl4 ® Cl – CH2 – CH2 – CH2 – CH2 – CCl3
|
из
5.00
|
Обсуждение в статье: Радикальная полимеризация |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

