 |
Главная |
Диаграмма равновесных составов
|
из
5.00
|
Диаграмма равновесных составов связывает составы паровой и жидкой фаз при определённых значениях давления и температуры системы. Линию равновесия можно построить по методике, изложенной в пункте 6.8.1, либо аналитически.
Для аналитического расчета линии равновесия запишем уравнение (6.31) для НКК и ВКК бинарной системы
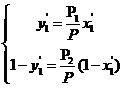 . (6.38')
. (6.38')
Разделив левые и правые части уравнений, получим выражение
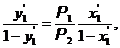 (6.39)
(6.39)
в котором отношение давления насыщенных паров компонентов называется коэффициентом относительной летучести и обозначается буквой 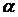 , т.е.
, т.е.
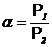 . (6.40)
. (6.40)
Поскольку давление насыщенных паров P1 и P 2 низко- и высококипящего компонентов изменяются в интервале температур tнкк и tвкк смеси, то для упрощения расчетов используют среднегеометрическое значение коэффициента относительной летучести
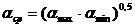 , (6.41)
, (6.41)
где 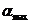 и
и 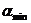 - относительные летучести при температурах кипения tнкк и tвкк..
- относительные летучести при температурах кипения tнкк и tвкк..
Коэффициент относительной летучести 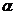 при понижении температуры обычно увеличивается.
при понижении температуры обычно увеличивается.
С учетом уравнений (6.39) и (6.40) из уравнения (6.38) получаем выражение
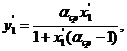 (6.42)
(6.42)
которое позволяет построить линию равновесия (рисунок 6.6)
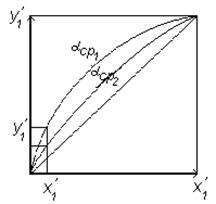
Из уравнения (6.42) следует зависимость обогащения паровой фазы НКК (y1’) от коэффициента относительной летучести:
при увеличении 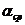 -
- 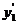 возрастает. На рисунке 6.6
возрастает. На рисунке 6.6 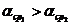 .
.
| Рисунок 6.6 - К определению влияния коэффициента летучести на положение линии равновесия |
Диаграммы состояния можно построить, выражая состав равновесных фаз в массовых долях. Для пересчета концентраций используют уравнение
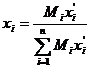 , (6.43)
, (6.43)
где Mi – мольная масса i-го компонента смеси.
Для бинарной смеси относительно концентрации НКК уравнение (6.43) записывается в виде
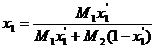 . (6.43')
. (6.43')
Мольную концентрацию i-го компонента по известной массовой концентрации (в долях) можно определить по уравнению
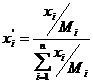 . (6.44)
. (6.44)
Взаимное положение кривых на изобарной диаграмме (t - x,y) и диаграмме равновесных составов (х - у) соответствует закону Коновалова, который устанавливает связь между изменениями состава, давления или температуры в двухфазных системах.
Закон Коновалова гласит, что пар всегда более обогащен НКК, чем соответствующая ему равновесная жидкая фаза.
На рисунке 6.5 при 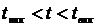 концентрации НКК в паровой фазе больше, чем в жидкой (
концентрации НКК в паровой фазе больше, чем в жидкой ( 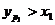 ). Аналогичный вывод можно сделать и по рисунку 6.6. Это положение лежит в основе теории перегонки и ректификации бинарных смесей.
). Аналогичный вывод можно сделать и по рисунку 6.6. Это положение лежит в основе теории перегонки и ректификации бинарных смесей.
Влияние давления на взаимное положение кривых на диаграммах состояния рассмотрим на примере смеси бензол-толуол при P=0,1; 0,5 и 1,0 МПа.
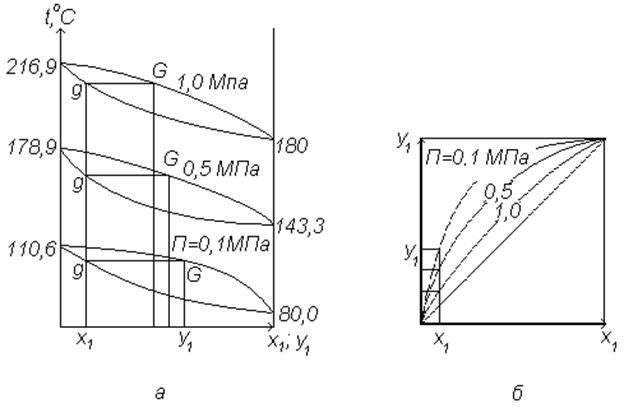
а – изобарная диаграмма; б – диаграмма равновесных составов
Рисунок 6.7 - Взаимное положение кривых равновесия при различных давлениях
Из рисунка 6.7 видно, что при одном и том же составе жидкой фазы (х1) наибольшая концентрация НКК в паровой фазе (у1) соответствует давлению P=0,1 МПа. Повышение давления снижает степень обогащения паровой фазы низкокипящим компонентом. Это обстоятельство используют при разделении смесей путем перегонки и ректификации.
На практике чаще приходится иметь дело с неидеальными системами, поведение которых отличается от идеальных систем и они, как правило, строятся по справочным или экспериментальным данным (рисунки 6.8 и 6.9).
Для двухкомпонентного идеального раствора при постоянной температуре
(t=const) парциальные давления компонентов Р1 и Р2 и общее давление паров P = Р1+Р2 подчиняется закону Рауля, изотерма жидкой фазы изображается прямой (линия 1, рисунок 6.8, I, a).
Реальные жидкие смеси могут значительно отклоняться от закона Рауля. Эти отклонения могут быть либо положительными, когда парциальные давления компонентов (Р1, Р2) и общее давление (P) выше, чем для идеальных растворов, либо отрицательными, когда Р1;Р2 и P меньше, чем следует из закона Рауля. Степень отклонения реальной системы выражается величиной коэффициента активностиγ, и уравнение Рауля имеет вид
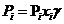 . (6.45)
. (6.45)
Для растворов с положительным отклонением от закона Рауля γ>1, для растворов с отрицательным отклонением γ<1.
Растворы с незначительным положительным или отрицательным отклонением от закона Рауля называются растворами нормального типа. Для них всегда соблюдается условие Р1<P<P2. Диаграммы парожидкостного равновесия таких систем приведены на рисунке 6.8, II.
Для многих реальных систем отклонение от закона Рауля настолько значительно, что приводит к качественно новому состоянию системы, а на фазовых диаграммах P-x,у и t-х,у появляются (рисунок 6.8 III, IV) относительный максимум или минимум. В точке экстремума (т.А на рисунке 6.8 III,IV) кривые жидкой и паровой фаз соприкасаются и составы равновесных фаз совпадают (хА=уА). Такие смеси называются азеотропными или нераздельно кипящими, т.к. при испарении смесь (азеотроп) не изменяет своего состава. Для разделения азеотропных смесей необходимы специальные методы (изменение давления, ректификация в присутствии третьего компонента и др.).
Эта особенность азеотропных смесей отражена вовтором законе Коновалова: если давление и температура сосуществования двух бинарных фаз имеет экстремум (максимум или минимум), то составы фаз одинаковы.
Примером азеотропа на рисунке 6.8, III может служить смесь сероуглерод-ацетон при P=87кПа. Температура азеотропа tA=35oC; состав (по сероуглероду) 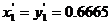 (температура кипения сероуглерода около 46оС; ацетона 56оС).
(температура кипения сероуглерода около 46оС; ацетона 56оС).
Примером азеотропа на рисунке 6.8, IV можно назвать смесь ацетон – хлороформ при P=0,1МПа. Температура кипения азеотропа tа =64,8 оС, состав (по ацетону) 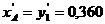 .
.
Диаграммы равновесия систем, жидкая фаза которых представлена жидкостями с ограниченной взаимной растворимостью, приведены на рисунке 6.9 (а). Примером такой системы является бинарная смесь вода-фенол, при равновесии которой образуется паровая фаза, находящаяся в равновесии с двумя жидкими фазами составов хM и хN. Причем хM <y<хN.
При изменении концентрации НКК в жидкости от 0 до хМ температура системы понижается от tВКК – температуры кипения ВКК (в рассматриваемом примере ВКК является фенол) до tА – температуры кипения азеотропа. Концентрация НКК (воды) в равновесных парах увеличивается от 0 до уА=хА.
В диапазоне концентраций исходного НКК от хM до хN образуются два жидких слоя, один из которых имеет концентрацию хM, а другой хN. Температуры кипения жидкостей в указанном интервале концентраций будут оставаться равной tА.
При увеличении концентрации исходного НКК в смеси свыше хN вновь образуется гомогенный раствор, а температура кипения смеси будет увеличиваться от tА до tНКК при одновременном увеличении концентрации исходного НКК в равновесных парах. В этой области концентраций роль НКК перейдет к исходному ВКК.
Кривая равновесия подобных систем изображена на рисунке 6.9.
Взаимная растворимость жидкостей зависит от их состава и температуры. Как правило, с увеличением температуры взаимная растворимость жидкостей возрастает. Поэтому при увеличении температуры диапазон концентраций НКК от ХM до XN будет уменьшаться. При температуре, выше критической (tкр) система двух жидкостей образует гомогенный раствор.
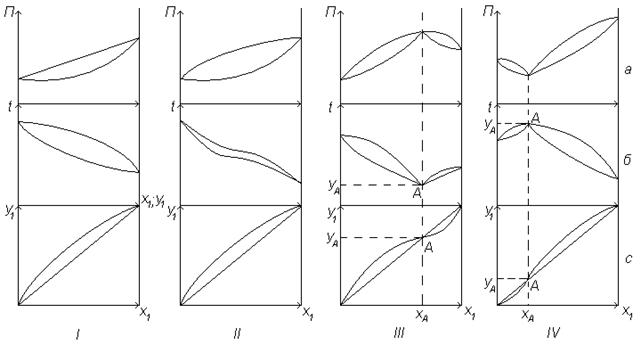
а – изотермная диаграмма (П – х,у; t=const); б – изобарная диаграмма (t – x,y; П = const); с – диаграмма равновесных составов (у-х); 1 – линия паровой фазы; 2 – линия жидкой фазы
Рисунок 6.8 – Диаграммы состояния жидкость-пар идеальной (I) и реальных (II, III, IV) систем с неограниченной взаимной растворимостью компонентов
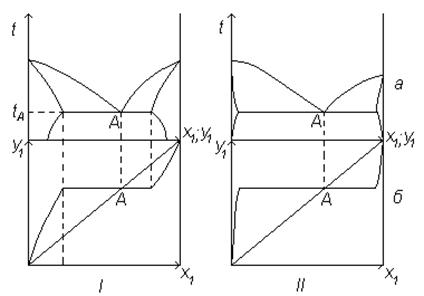
а – изобарная диаграмма (t-х,у; П=const); б – диаграмма равновесных составов (у-х)
Рисунок 6.9 - Диаграммы состояния жидкость-пар для систем с ограниченной взаимной растворимостью (I) и взаимно нерастворимых (II) жидкостей
|
из
5.00
|
Обсуждение в статье: Диаграмма равновесных составов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

