 |
Главная |
Некоторые законы идеальных газов и растворов
|
из
5.00
|
Существование фаз равновесной системы возможно лишь при определенных условиях. При изменении этих условий равновесие системы нарушается и имеет место переход вещества из одной фазы в другую.
Количество параметров, изменение которых не нарушает равновесия системы, определяется правилом фаз или законом равновесия фаз Гиббса
С=К+2-Ф, (6.20)
где С – число степеней свободы или независимых параметров (температура, давление, концентрация), значение которых можно изменять в определенных пределах, не нарушая равновесия системы;
К – число компонентов системы;
Ф – число фаз системы;
2 – число внешних факторов, влияющих на положение равновесия в системе (для массопереноса внешними факторами являются температура и давление).
Рассмотрим применение правила фаз Гиббса для некоторых частных случаев.
1) Для однокомпонентной парожидкостной равновесной системы (например, насыщенный водяной пар) С = 1+2–2=1, следовательно, из определяющих состояние системы параметров (P, t, состав паровой фазы) можно выбрать только один параметр и тогда одназначно определяться значения других, например, давление насыщенных паров воды (P) зависит лишь от температуры. Таким образом, для любого другого компонента (i-го) можно записать
Pi=f(t), (6.21)
Для большинства компонентов зависимость (6.21) приведена в справочной литературе. Для аналитического расчета широко применяется эмпирическое уравнение Антуана
 , (6.22)
, (6.22)
где Ai, Bi, Ci – коэффициенты Антуана, значение которых для индивидуальных компонентов приведены в справочной литературе.
2) Однокомпонентная равновесная система, состоящая из трех фаз (пар – жидкость – твердое тело) не имеет степеней свободы (С=1+2-Ф=0), то параметры равновесия чётко определены. Например, система вода – лед – водяной пар находится в равновесии только при давлении 610,6 Па и температуре 0,0076оС.
3) Двухкомпонентная равновесная парожидкостная система имеет две степени свободы (С=2+2-2=2), т.е. достаточно задаться t, P, чтобы получить значения концентраций компонентов в равновесных паровой и жидкой фазах.
В этом случае одной из переменных (например, давлением) задаются и получают однозначную зависимость между температурой и концентрацией или (при постоянной температуре) – между давлением и концентрацией. Зависимость между параметрами (температура – концентрация, давление – концентрация) строят в плоских координатах. Такие диаграммы называют фазовыми или диаграммами состояния.
Идеальной называется система, паровая фаза которой является идеальным газом, а жидкая – идеальным раствором.
Идеальнымсчитается газ, состоящий из упругих молекул, между которыми отсутствует силы межмолекулярного взаимодействия и размеры которых пренебрежимо малы по сравнению с межмолекулярным объемом.
Состояние идеального газа можно описать уравнением Менделеева-Клапейрона
PiVi=NiRT, (6.23)
где Pi – абсолютное (или парциальное) давление i-го компонента;
Vi – абсолютный объем;
Ni – число молей i-го компонента.  (здесь gi – масса i-го компонента; Mi – его мольная масса);
(здесь gi – масса i-го компонента; Mi – его мольная масса);
R – универсальная газовая постоянная (при нормальных условиях (То=273К и Pо=0,1 МПа) R=8,314 Дж/(моль·К));
Т – абсолютная температура, К.
Смесь идеальных газов подчиняется законам аддитивности парциальных давлений и парциальных объемов.
Парциальным давлением компонента (Рi) газовой смеси называют давление, которое имел бы компонент, находясь при температуре и давлении смеси, при условии, что все другие компоненты удалены.
В соответствии с законом аддитивности давление (P) смеси идеальных газов равно сумме парциальных давлений компонентов
 , (6.24)
, (6.24)
где n – число компонентов газовой смеси.
Парциальным объемом компонента (Vi) газовой смеси называется объем, которой занимал бы компонент, находясь при температуре и давлении смеси, при условии, что все другие компоненты удалены.
В соответствии с законом аддитивности объем смеси идеальных газов (Vm) равен сумме парциальных объемов компонентов
 . (6.25)
. (6.25)
Запишем уравнение Менделеева-Клапейрона (6.23) для i-го компонента газовой смеси при условии Vi=Vm и для смеси газов (с учетом уравнений 6.24 и 6.25)
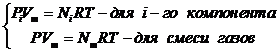 , (6.26)
, (6.26)
где Nm – число молей компонентов смеси.
Разделив левые и правые части уравнений системы, получим
 ;
;  . (6.27)
. (6.27)
Выражение (6.27) есть математическое выражение закона Дальтона, согласно которому парциальное давление компонента газовой смеси равно произведению общего давления на мольную долю компонента в смеси.
Запишем уравнение Менделеева-Клайперона (6.23) для двух компонентов газовой смеси (при условии Vi=Vm)
 (6.27')
(6.27')
После несложных преобразований можно получить уравнение Авогадро-Дальтона
 (6.28)
(6.28)
согласно которому массовое соотношение компонентов газовой смеси равно отношению произведений их парциальных давлений на мольную массу.
Идеальным считается раствор, при образовании которого не наблюдается теплового эффекта.
К идеальным растворам применим закон Рауля, согласно которому парциальное давление пара i-го компонента (Рi) над раствором равно произведению давления насыщенного пара чистого компонента (Pi) при температуре раствора на его мольную долю в жидкой фазе (  ).
).
Математически закон Рауля можно записать
Pi=Pi  . (6.29)
. (6.29)
|
из
5.00
|
Обсуждение в статье: Некоторые законы идеальных газов и растворов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

