 |
Главная |
Кристаллизация. Общие сведения о процессе; область применения. Материальный и тепловой балансы кристаллизации
|
из
5.00
|
Кристаллизацией называется процесс выделения твердой фазы в виде кристаллов из растворов и расплавов, а также из газов и паров.
Кристаллизация применяется для разделения смесей, глубокой очистки веществ от примесей, выделения твердой фаза из растворов и расплавов, выращивания монокристаллов. Получение большого количества кристаллов в промышленном масштабе называют массовой кристаллизацией (применяется в производстве минеральных удобрений). Фракционная кристаллизация применяется для разделения расплавов.
Основными достоинствами кристаллизации являются низкие энергозатраты (удельная теплота плавления в 6…8 раз меньше теплоты испарения), низкие температуры процесса, возможность разделения азеотропных смесей и смесей, содержащих компоненты с близкими температурами кипения, высокая эффективность.
Кристаллизация из раствора осуществляется вследствие изменения растворимости кристаллируемого компонента в исходной смеси.
Растворы, находящиеся в равновесии в твердой фазой при определенной температуре, называются насыщенными. Пересыщенные растворы являются неустойчивыми и легко переходят в состояние насыщения. При этом из них выделяется избыточное количество растворенного вещества – происходит процесс кристаллизации. Насыщенный раствор, образующийся после прекращения выделения кристаллов, называется маточным или маточником. Для отделения кристаллов от маточника используют отстаивание, фильтрование, центрифугирование и др.
Кристаллизация состоит из двух основных стадий – образования зародышей кристаллов и роста кристаллов, протекающих практически одновременно. Если скорость образования зародышей кристаллов больше скорости их роста, то получается большое количество мелких кристаллов; если наоборот – от образуются кристаллы больших размеров, но в меньшем количестве.
Начало образования зародышей кристаллов происходит в центрах кристаллизации, в роли которых выступают различные механические примеси, шероховатость стенок и другие случайные факторы. Скорость образования зародышей можно увеличить добавлением в раствор мелких частиц кристаллизующегося вещества (затравки), перемешиванием, встряхиванием, добавкой поверхностно активных веществ (ПАВ), ультразвуковым воздействием.
В соответствии со способом получения перенасыщенного раствора различают изотермическую кристаллизацию, при котором удаляется часть растворителя путем испарения, вымораживания либо выпаривания, и изогидрическую кристаллизацию, которая достигается путем охлаждения раствора.
Растворимость твердых веществ в жидких растворителях зависит от их химической природы, свойств растворителя, температуры и давления. В качестве растворителей наиболее часто используют воду и органические растворители – спирты, углеводороды и др.
Растворимость большинства веществ с повышением температуры увеличивается. При понижении температуры такие растворы становятся пересыщенными и переходят в состояние неустойчивого равновесия, продолжительность которого определяется степенью отклонения от равновесия, свойствами растворенного вещества и растворителя. Переход из неравновесного состояния в равновесное сопровождается выпадением кристаллов, т.е. протекает процесс кристаллизации.
Анализ условий равновесия при кристаллизации удобно проводить с помощью диаграмм состояния раствора в координатах концентрация – температура.
Пользуясь диаграммами состояния растворов (рисунок 7.36), можно выяснить поведение раствора при его кристаллизации получить данные для выбора наиболее эффективного способа проведения процесса кристаллизации. На рисунке 7.36 изображены диаграммы состояний для трех бинарных систем. В каждой системе ниже линий 1-1 (линии растворимости) находится область ненасыщенных растворов (область В). Пунктирная линяя 2-2 условно делит область пересыщенных растворов на две части. Между линиями 1-1 и 2-2 расположена относительно устойчивая, или метастабильная область Б и над линией 2-2 неустойчивая, или лабильная, область А.

1-1 – кривые растворимости; 2-2 – границы метастабильной области (условно); А – область лабильных растворов; Б – область метастабильных растворов; В – область стабильных растворов
Рисунок 7.36 – Диаграммы состояния растворов
Пересыщенные растворы с концентрациями, соответствующими лабильной области, кристаллизуются мгновенно, в метастабильной же области эти растворы то или иное время остаются без изменения.
Границы метастабильной области зависят от большого числа факторов: температуры раствора, скорости его охлаждения идя испарения, перемешивания и др. Так, у соединений с резко возрастающей кривой растворимости (рисунок 7.36, а), при относительно небольшом снижении температуры насыщенного раствора от t  до t
до t  состояние раствора отвечает сначала метастабильной области (на небольшом участке от с
состояние раствора отвечает сначала метастабильной области (на небольшом участке от с  до с
до с  ), а затем — области пересыщенных растворов, где происходит выделение твердой фазы. При этом раствор снова становится насыщенным и его концентрация значительно уменьшается (от с
), а затем — области пересыщенных растворов, где происходит выделение твердой фазы. При этом раствор снова становится насыщенным и его концентрация значительно уменьшается (от с  до с’
до с’  ).
).
Кристаллизацию подобных растворов, близких к насыщению, целесообразно вести путем их охлаждения, осуществляя быстрый переход в благоприятную для кристаллизации метастабильную область.
Для соединений, растворимость которых более медленно возрастает с увеличением температуры (рисунок 7.36, б), переход в область пересыщенных растворов (из точки с  до с
до с  ) происходит лишь при значительном снижении температуры. При этом количество выпавшей из раствора твердой фазы невелико (оно пропорционально изменению концентраций от с
) происходит лишь при значительном снижении температуры. При этом количество выпавшей из раствора твердой фазы невелико (оно пропорционально изменению концентраций от с  до
до  ). Как видно из рисунка, состояние раствора, соответствующее области его пересыщения, может быть быстро достигнуто и при постоянной температуре (вертикальный участок от точки с
). Как видно из рисунка, состояние раствора, соответствующее области его пересыщения, может быть быстро достигнуто и при постоянной температуре (вертикальный участок от точки с  до точки с”
до точки с”  ). Это указывает на возможность кристаллизации раствора и путем удаления части растворителя. Для таких растворов вопрос о выборе оптимального способа кристаллизации можно решить только технико-экономическим расчетом.
). Это указывает на возможность кристаллизации раствора и путем удаления части растворителя. Для таких растворов вопрос о выборе оптимального способа кристаллизации можно решить только технико-экономическим расчетом.
На рисунке 7.36,в рассмотрен случай, когда растворимость кристаллизуемого вещества почти не изменяется в широком диапазоне температур. При этом целесообразно осуществлять кристаллизацию путем выпаривания.
При сильном пересыщении растворов образуется много зародышей, поэтому во всех случаях степень пересыщения должна быть такой, чтобы количество возникающих зародышей было наименьшим, а кристаллы росли достаточно быстро. Поэтому кристаллизацию нужно вести из растворов с умеренным пересыщением на метастабильной области (точка с’  ).
).
Материальный баланс кристаллизации
Обозначим
 ,
, 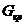 ,
,  - расход соответственно исходного раствора, полученных кристаллов и маточного раствора, кг/с;
- расход соответственно исходного раствора, полученных кристаллов и маточного раствора, кг/с;
 ,
,  - концентрация растворенного вещества в исходном и маточном растворах (масс.д.);
- концентрация растворенного вещества в исходном и маточном растворах (масс.д.);
 - отношение мольных масс абсолютно сухого растворенного вещества и кристаллосольвата (для водного раствора - кристаллогидрата); при кристаллизации без присоединения молекул растворителя
- отношение мольных масс абсолютно сухого растворенного вещества и кристаллосольвата (для водного раствора - кристаллогидрата); при кристаллизации без присоединения молекул растворителя  и
и  ;
;
W – расход удаляемого растворителя, кг/с.
Материальный баланс с удалением части растворителя
- в общем виде
 ; (7.44)
; (7.44)
- по абсолютно сухому растворенному веществу
 . (7.45)
. (7.45)
Массовый расход полученных кристаллов определяется совместным решением уравнений (7.44) и (7.45). Обычно  известны, W вычисляют при помощи уравнения по заданным
известны, W вычисляют при помощи уравнения по заданным  . Значение G
. Значение G  составляет:
составляет:
 . (7.46)
. (7.46)
При а = 1 имеем
 . (7.47)
. (7.47)
Кристаллизация без удалении растворителя (W = 0). Количество полученных кристаллов
 . (7.48)
. (7.48)
При а = 1 находим
 . (7.49)
. (7.49)
При испарении растворителя в газ (воздух) расход газа (в кг) определяется из уравнения
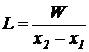 , (7.50)
, (7.50)
где L - расход сухого газа (воздуха), кг;
x1, x2 - начальное и конечное влагосодержание газа (воздуха), кг влаги/кг сухого газа.
Тепловой баланс непрерывной кристаллизации.
При растворении твердого кристаллического вещества происходит поглощение тепла q  для разрушения кристаллической решетки (теплота плавления) и выделение тепла при химическом взаимодействии вещества с растворителем q
для разрушения кристаллической решетки (теплота плавления) и выделение тепла при химическом взаимодействии вещества с растворителем q 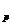 (образование гидратов). В зависимости от значений q
(образование гидратов). В зависимости от значений q  и q
и q 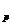 тепловой эффект кристаллизации будет положительным или отрицательным.
тепловой эффект кристаллизации будет положительным или отрицательным.
Помимо принятых в материальном балансе введем следующие обозначения:  - энтальпия раствора, кристаллов и маточного раствора, кдж/кг;
- энтальпия раствора, кристаллов и маточного раствора, кдж/кг;  - начальная и конечнаи энтальпия теплоносителя, кДж/кг;
- начальная и конечнаи энтальпия теплоносителя, кДж/кг; 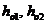 - начальная и конечная энтальпия охлаждающей среды» кдж/кг; H - энтальпия парообразного растворителя, кдж/кг; r - теплота образования кристаллической решетки (теплота затвердевания), кдж/кг кристаллов;
- начальная и конечная энтальпия охлаждающей среды» кдж/кг; H - энтальпия парообразного растворителя, кдж/кг; r - теплота образования кристаллической решетки (теплота затвердевания), кдж/кг кристаллов;  - тепловой эффект концентрирования раствора при изменении его концентрации от
- тепловой эффект концентрирования раствора при изменении его концентрации от  до
до  ; кдж/кг; G
; кдж/кг; G  , G
, G  — количество теплоносителя или охлаждающей среды, кг/сек.
— количество теплоносителя или охлаждающей среды, кг/сек.
В общем случае будем иметь:
Приход тепла
- с раствором  ;
;
- теплота кристаллизации  ;
;
- теплота дегидратации  ;
;
- получено от теплоносителя  .
.
Расход тепла
- с кристаллами  ;
;
- с маточным раствором  ;
;
- с парами растворителя  ;
;
- с охлаждающим агентом  ;
;
- потери в окружающую среду  .
.
Тогда можно записать:
 . (7.51)
. (7.51)
При кристаллизации с охлаждением  = 0 и
= 0 и 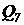 =0; при кристаллизации с испарением части растворителя
=0; при кристаллизации с испарением части растворителя  = 0; при вакуум-кристаллизации
= 0; при вакуум-кристаллизации  = 0 и
= 0 и  = 0.
= 0.
Для теплоносителя — насыщенного водяного пара (в кдж/сек)
 , (7.52)
, (7.52)
где  - энтальпия пара и конденсата, кдж/кг;
- энтальпия пара и конденсата, кдж/кг;
D — расход пара, кг/сек.
Для охлаждающей среды—воздуха (в кдж/сек)
 , (7.53)
, (7.53)
где L - расход сухого воздуха, кг/сек; 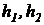 - его начальная и конечная энтальпии, кдж/кг.
- его начальная и конечная энтальпии, кдж/кг.
В зависимости от температурных условий потери тепла  могут быть положительны или отрицательны.
могут быть положительны или отрицательны.
|
из
5.00
|
Обсуждение в статье: Кристаллизация. Общие сведения о процессе; область применения. Материальный и тепловой балансы кристаллизации |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

