 |
Главная |
Химическая связь. Типы и виды химической связи. Метод валентных схем. Метод молекулярных орбиталей.
|
из
5.00
|
Химической связью называют взаимодействие между атомами, приводящее к образованию молекул или ионов и прочному удерживанию атомов друг около друга. Химическая связь имеет электронную природу, т. е. осуществляется за счёт взаимодействия валентных электронов. В зависимости от распределения валентных электронов в молекуле, различают следующие виды связей: ионная, ковалентная, металлическая и др. Ионную связь можно рассматривать как предельный случай ковалентной связи между атомами, резко отличающимися по природе. ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ. Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий(Na), калий(K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами. Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия (NaOH) и сульфате натрия (Na2 SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные). Ковалентная неполярная связь. При взаимодействии атомов с одинаковой электроотрица-тельностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах следующих простых веществ: H2 , F2 , Cl2 , O2 , N2 . Химические связи в этих газах образованы посредством общих электронных пар, т.е. при перекрывании соответствующих электронных облаков, обусловленном электронно ядерным взаимодей-ствием, которые осуществляет при сближении атомов. Составляя электронные формулы веществ, следует помнить, что каждая общая электронная пара – это условное изображение повышенной электронной плотности, возникающей в результате перекрывания соответствующих электронных облаков. Ковалентная полярная связь. При взаимодействии атомов, значение электроотрецательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях. К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония и амония. Металлическая связь. Связь, которая образуется в результате взаимодействия относите-льно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен для простых веществ- металлов. Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свобо-дные электроны, оторвавшиеся от атома, перемещаются между положи-тельными ионами металлов. Между ними возникает металлическая связь, т. е. Электроны как бы цементируют положительные ионы кристал-лической решетки металлов. Водородная связь. Связь, которая образуется между атомов водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, F) другой молекулы, называется водородной связью. Может возникнуть вопрос: почему именно водород образует такую специфическую химическую связь? Это объясняется тем, что атомный радиус водорода очень мал. Кроме того, при смещении или полной отдаче своего единственного электрона водород приобретает сравнительно высокий положительный заряд, за счет которого водород одной молекулы взаимодействует с атомами электроотрицательных элементов, имеющих частичный отрицательный заряд, выходящий в состав других молекул (HF, H2 O, NH3 ). Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой:
H-Cl, H-H, H-O-H
В основе метода ВС лежат следующие положения: Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
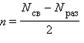 Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Метод ВС основан на идее образования химической связи парой электронов, принадлежащей двум атомам. Согласно методу МО электроны, образующие химическую связь, движутся в поле, образуемом ядрами всех атомов, составляющих молекулу, т.е. электроны принадлежат всем атомам молекулы. Следовательно, молекулярные орбитали являются в общем случае многоцентровыми. Введем понятие порядок связи. В двухатомных молекулах, порядок связи показывает насколько число связывающих электронных пар превышает число разрыхляющих электронных пар:
Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Метод ВС основан на идее образования химической связи парой электронов, принадлежащей двум атомам. Согласно методу МО электроны, образующие химическую связь, движутся в поле, образуемом ядрами всех атомов, составляющих молекулу, т.е. электроны принадлежат всем атомам молекулы. Следовательно, молекулярные орбитали являются в общем случае многоцентровыми. Введем понятие порядок связи. В двухатомных молекулах, порядок связи показывает насколько число связывающих электронных пар превышает число разрыхляющих электронных пар:
Метод молекулярных орбиталей описывает энергетическое состояние валентных электронов в атоме.
Основные положения: 1. Электроны в молекуле принадлежат ядрам всех атомов, составляющих молекулу. 2. При образовании связи электроны с атомных орбиталей переходят на молекулярные орбитали. Из двух атомных орбиталей образуются две молекулярные орбитали. Одна из них – связывающая, обладает энергией более низкой чем исходные атомные орбитали (волновые функции электронов складываются и происходит выигрыш энергии). Вторая молекулярная орбиталь – разрыхляющая, которая обладает более высоким уровнем энергии, чем исходные атомные орбитали (волновые функции электрона вычитаются и преобладают силы отталкивания). Из n атомных орбиталей образуется n молекулярных орбиталей. 3. Заполнение электронами молекулярных орбиталей происходит в соответствии с теми же правилами, что и атомных орбиталей: 1) принцип минимальной энергии (Клечковского); 2) принцип Паули; 3) правило Хунда; 4. По методу молекулярных орбиталей можно вычислить порядок связи: p = (nсв - nразр )/ 2 , где nсв – число электронов на связывающей орбитали, nразр - число электронов на разрыхляющей орбитали.
|
из
5.00
|
Обсуждение в статье: Химическая связь. Типы и виды химической связи. Метод валентных схем. Метод молекулярных орбиталей. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

