 |
Главная |
Растворы электролитов. Основные положения теории электролитической диссоциации.
|
из
5.00
|
Электролит – это вещество, которое при определенных условиях способно распадаться на заряженные частицы, называемые ионами. Под определенными условиями может подразумеваться раствор, расплав, распад на ионы под действием температуры (термодиссоциация CaCO3 « CaO + CO2), в плазме и фотодиссоциация – разложение веществ под действием ионизирующего излучения (Cl2 2Cl). Раствор электролита – это раствор, который способен проводить электрический ток. Электролитами называют вещ-ва, которые в полярных растворителях или в расплавленном виде распадаются на ионы и проводят электрический ток. Вследствие диссоциации растворы и расплавы электролитов проводят электрический ток. Образование ионов в расплаве происходит в результате разрушения ионной кристаллической решётки-это физический процесс. В растворе распад электролита на ионы осуществляется в результате химического взаимодействия растворяемого электролита с молекулами растворителя. По способности к диссоциации в растворе электролиты делятся на сильные и слабые. Сильные электролиты диссоциируют на ионы полностью, слабые-частично. Пусть KnAm-сильный электролит. Уравнение его диссоциации записывается как уравнение необратимого процесса: KnAm=nKm+ + mAn-. Например, Al2(SO4)3=2Al3++3(SO4)2-. В растворе сильного электролита концентрация его ионов определяется исключительно концентрацией раствора. Шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации. Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов — катионов и анионов. Процесс диссоциации во всех случаях является обратимым, поэтому при написании уравнений реакции диссоциации необходимо применять знак обратимости « . Различные электролиты, согласно теории Аррениуса, диссоциируют на ионы в различной степени. Полнота распада зависит от природы электролита, его концентрации, природы растворителя, температуры. Основные положения теории электролитической диссоциации 1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные. 2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные частицы движутся к катоду, отрицательно заряженные – к аноду. Поэтому положительно заряженные частицы называются катионами, а отрицательно заряженные – анионами. 3. Направленное движение происходит в результате притяжения их противоположно заряженными электродами (катод заряжен отрицательно, а анод – положительно). 4. Ионизация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов в молекулы (ассоциация). Основываясь на теории электролитической диссоциации, можно дать следующие определения для основных классов соединений: Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Например,HCl → H+ + Cl-; CH3COOH 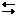 H+ + CH3COO-. Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, HCl, HNO3 – одноосновные кислоты, H2SO4, H2CO3 – двухосновные, H3PO4, H3AsO4 – трехосновные. Основаниями называют электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например, KOH → K+ + OH-, NH4OH
H+ + CH3COO-. Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Так, HCl, HNO3 – одноосновные кислоты, H2SO4, H2CO3 – двухосновные, H3PO4, H3AsO4 – трехосновные. Основаниями называют электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например, KOH → K+ + OH-, NH4OH 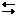 NH4+ + OH-. Растворимые в воде основания называются щелочами. Кислотность основания определяется числом его гидроксильных групп. Например, KOH, NaOH – однокислотные основания, Ca(OH)2 – двухкислотное, Sn(OH)4 – четырехкислотное и т.д. Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также ион NH4+) и анионы кислотных остатков. Например,CaCl2→ Ca2+ + 2Cl-, NaF → Na+ + F-. Электролиты, при диссоциации которых одновременно, в зависимости от условий, могут образовываться и катионы водорода, и анионы – гидроксид-ионы называются амфотерными. Например,H2O
NH4+ + OH-. Растворимые в воде основания называются щелочами. Кислотность основания определяется числом его гидроксильных групп. Например, KOH, NaOH – однокислотные основания, Ca(OH)2 – двухкислотное, Sn(OH)4 – четырехкислотное и т.д. Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также ион NH4+) и анионы кислотных остатков. Например,CaCl2→ Ca2+ + 2Cl-, NaF → Na+ + F-. Электролиты, при диссоциации которых одновременно, в зависимости от условий, могут образовываться и катионы водорода, и анионы – гидроксид-ионы называются амфотерными. Например,H2O 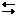 H+ + OH-, Zn(OH)2
H+ + OH-, Zn(OH)2 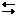 Zn2+ + 2OH-, Zn(OH)2
Zn2+ + 2OH-, Zn(OH)2 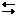 2H+ + ZnO22- или Zn(OH)2 + 2H2O
2H+ + ZnO22- или Zn(OH)2 + 2H2O 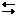 [Zn(OH)4]2- + 2H+.
[Zn(OH)4]2- + 2H+.
|
из
5.00
|
Обсуждение в статье: Растворы электролитов. Основные положения теории электролитической диссоциации. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

