 |
Главная |
Кислоты. Классификация кислот. Химические свойства кислот. Примеры?
|
из
5.00
|
Кислотаминазываются сложные вещества, состоящие из атомов водорода и кислотных остатков. С точки зрения теории электролитической диссоциации кислоты – это электролиты, диссоциирующие в водных растворах на катионы только водорода Н+ и анионы кислотных остатков. Если кислота одноосновная, то она диссоциирует в одну ступень: HCI H+ + CI 
 HNO3 H+ + NO3
HNO3 H+ + NO3 
Если кислота многоосновная, то она диссоциирует ступенчато: H3PO4 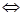 H+ + H2PO4
H+ + H2PO4  (первая ступень),
(первая ступень),
H2PO4 
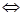 H+ + HPO42
H+ + HPO42  (вторая ступень), HPO42
(вторая ступень), HPO42 
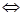 H+ + PO43
H+ + PO43  (третья ступень).
(третья ступень).
Ступенчатой диссоциацией многоосновных кислот объясняется образование кислых солей.
Классификация. По наличию (отсутствию) кислорода в составе кислот они подразделяются на кислородсодержащие (например, H3PO4 и H2SO4) и бескислородные (например, HCl и HBr). По основности (числу ионов H+, образующихся при полной диссоциации, или количеству ступеней диссоциации) кислоты делятся на одноосновные (если образуется один ион H+: HCl  H+ + Cl–; одна ступень диссоциации) и многоосновные – двухосновные (если образуются два иона H+: H2SO4
H+ + Cl–; одна ступень диссоциации) и многоосновные – двухосновные (если образуются два иона H+: H2SO4  2H+ + SO42–; две ступени диссоциации), трехосновные (если образуются три иона H+: H3PO4
2H+ + SO42–; две ступени диссоциации), трехосновные (если образуются три иона H+: H3PO4  3H+ + PO43–; три ступени диссоциации) и т.д.
3H+ + PO43–; три ступени диссоциации) и т.д.
Химические свойства кислот. 1) Диссоциация: HCl + nH2O  H+×kH2O + Cl–×mH2O (сокращенно: HCl
H+×kH2O + Cl–×mH2O (сокращенно: HCl  H+ + Cl– ). Многоосновные кислоты диссоциируют по ступеням (в основном по первой):
H+ + Cl– ). Многоосновные кислоты диссоциируют по ступеням (в основном по первой):
H2SO4  H+ + НSO4– (1 ступень) и HSO4–
H+ + НSO4– (1 ступень) и HSO4–  H+ + SO42– (2 ступень).
H+ + SO42– (2 ступень).
2) Взаимодействие с индикаторами: индикатор + Н+ (кислота)  окрашенное соединение.
окрашенное соединение.
Фиолетовый лакмус и оранжевый метилоранж окрашиваются в кислых средах в розовый цвет, бесцветный раствор фенолфталеина не меняет своей окраски.
3) Разложение. При разложении кислородсодержащих кислот получаются кислотный оксид и вода.
H2SiO3 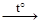 SiO2 + H2O.
SiO2 + H2O.
Бескислородные кислоты распадаются на простые вещества: 2HCl 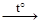 Cl2 + H2.
Cl2 + H2.
Кислоты-окислители разлагаются сложнее: 4НNO3 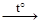 4NO2 + 2H2O + O2.
4NO2 + 2H2O + O2.
4) Взаимодействие с основаниями и амфотерными гидроксидами:
H2SO4 + Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42– + Ca2+ +2OH– ® CaSO4¯ + 2H2O
H2SO4 + Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
5) Взаимодействие с основными и амфотерными оксидами:
H2SO4 + CaO ® CaSO4¯ + H2O 2H+ + SO42– + CaO ® CaSO4¯ + H2O
H2SO4 + ZnO ® ZnSO4 + H2O 2H+ + ZnO ® Zn2+ + H2O.
6) Взаимодействие с металлами: а) кислоты-окислители по Н+ (HCl, HBr, HI, HClO4, H2SO4, H3PO4 и др.).
В реакцию вступают металлы, расположенные в ряду активности до водорода:
Li , Rb , K , Ba , Sr , Ca , Na , Mg , Al , Mn , Zn , Cr , Fe , Cd , Co , Ni , Sn , Pb , H , Sb , Bi , Cu , Hg , Ag , Pd , Pt , Au
2HCl + Fe ® FeCl2 + H2 2H+ + Fe ® Fe2+ + H2.
б) кислоты-окислители по аниону (концентрированная серная, азотная любой концентрации):
2Fe + 6H2SO4 (конц.) 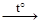 Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
2Fe + 12H+ + 3SO42– ® 2Fe3+ + 3SO2 + 6H2O.
7) Взаимодействие с солями. Реакция происходит, если соль образована более слабой или летучей кислотой, или если образуется осадок:
2HCl + Na2CO3 ® 2NaCl + CO2 + H2O 2H+ + CO32– ® CO2 + H2O
СaCl2 + H2SO4 ® CaSO4¯ + 2HCl Сa2+ + SO42- ® CaSO4¯.
|
из
5.00
|
Обсуждение в статье: Кислоты. Классификация кислот. Химические свойства кислот. Примеры? |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

